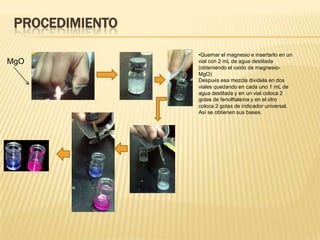
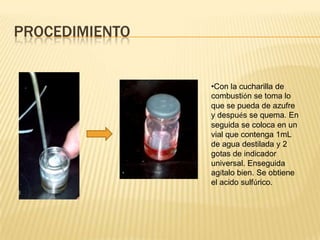
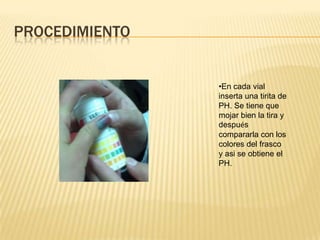
Este documento describe un experimento para formar ácidos y bases a partir de magnesio, azufre y carbono mediante reacciones de oxidación. Se detallan los materiales, procedimientos y resultados, incluyendo la formación de óxidos de magnesio, ácido sulfúrico y ácido carbónico, y la medición de sus pH. El experimento concluye que los ácidos se pueden identificar por su color cuando se les agrega indicador universal y que la oxidación determina el grado de oxidación de las sustancias.