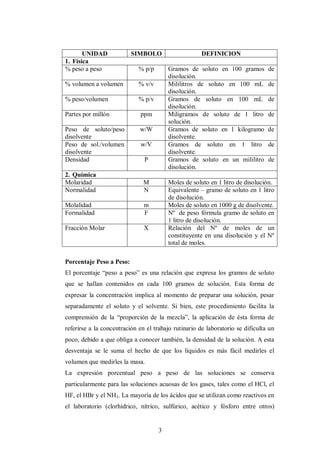
Este documento presenta información sobre la preparación de soluciones en el laboratorio. Explica los componentes básicos de una solución, incluyendo solvente, soluto, y diferentes tipos de soluciones clasificadas por su naturaleza, propiedades químicas y concentración. Luego, detalla los procedimientos experimentales para preparar una solución de cloruro de sodio al 5% p/p, incluyendo la medición de su densidad y cálculo de errores. El objetivo es que los estudiantes adquieran habilidades en la preparación