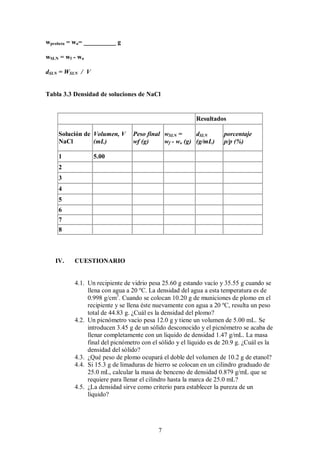
Este documento presenta un laboratorio sobre la densidad de sólidos y líquidos. Explica tres métodos para medir la densidad: el picnómetro, la probeta y el principio de Arquímedes. Los estudiantes aplicarán estos métodos para determinar la densidad de sustancias como agua, etanol, plomo y zinc, y analizarán cuál método es el más exacto. También medirán la densidad de soluciones de cloruro de sodio y responderán preguntas sobre cálculos relacionados a la densidad.