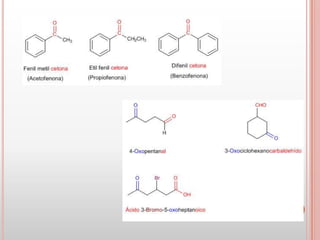
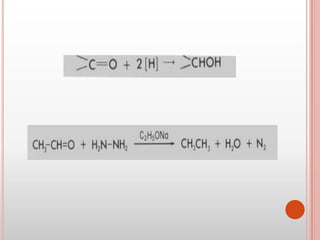
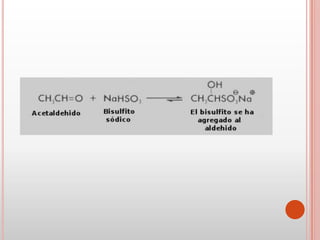
Las cetonas y aldehídos son compuestos orgánicos caracterizados por poseer un grupo funcional carbonilo. Las cetonas tienen el grupo carbonilo unido a dos átomos de carbono, mientras que los aldehídos lo tienen unido a un átomo de carbono y uno de hidrógeno. El documento describe las propiedades físicas y químicas de ambos compuestos, incluyendo su nomenclatura, fuentes naturales, reacciones características y usos.