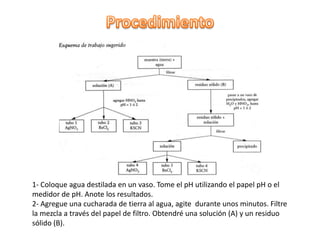
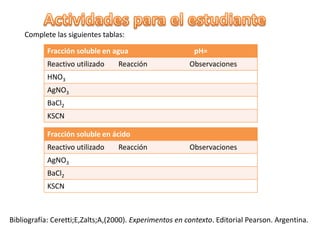
El documento describe el análisis del suelo a través de un experimento que investiga la solubilidad de sus componentes en agua y en medios ácidos. Se presentan procedimientos detallados para realizar pruebas de pH y observar reacciones químicas con diversos reactivos, lo que permite identificar la presencia de iones como cloruro, sulfato y hierro. Además, se discute la influencia del tipo de suelo en los resultados obtenidos y las variaciones en pH.