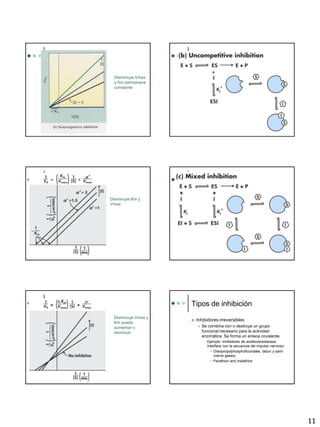
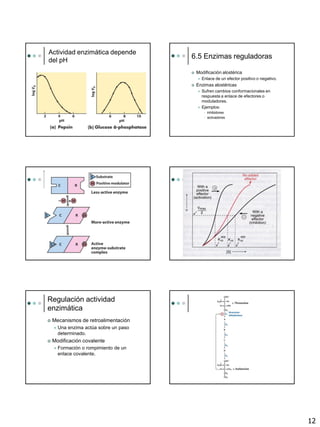
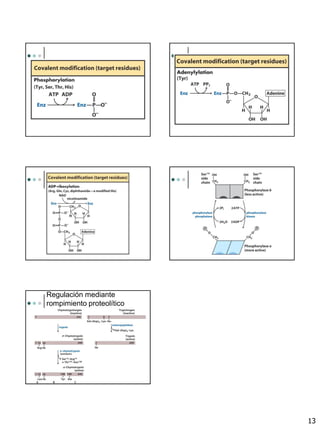
El documento proporciona una introducción a las enzimas, incluyendo su historia, propiedades generales y componentes. Describe cómo funcionan las enzimas mediante la teoría de la llave y la cerradura y la adaptación inducida. Explica la cinética enzimática, incluyendo la ecuación de Michaelis-Menten y los conceptos de Km, Vmax y número de rotación. También cubre los diferentes tipos de inhibición enzimática.






![8
Ecuación Michaelis-Menten
Paso #3
Ecuación Michaelis-Menten
Paso #4
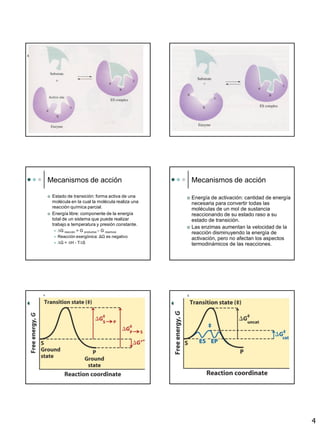
Significado Km y Vmax
KM es igual a la concentración de sustrato
cuando 50% de los centros activos de la
enzima están ocupados. También
representa cuán fuerte la enzima se enlaza
al sustrato.
VMAX está relacionado con el turnover
number: número de moles de sustrato
transformado en producto por mol de
enzima por segundo.
Mayor el “turnover number” mayor la
eficiencia.
Equivale a: Vmax/[Et]](https://image.slidesharecdn.com/cap6enzimas034412-221130231737-d29880f7/85/CAP-6-Enzimas_034412-pdf-8-320.jpg)