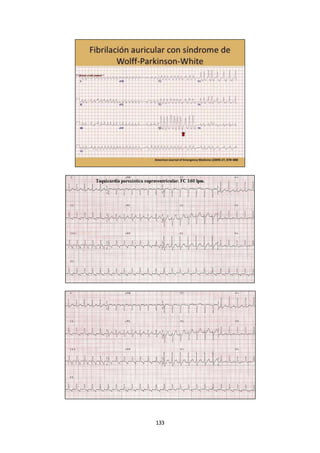
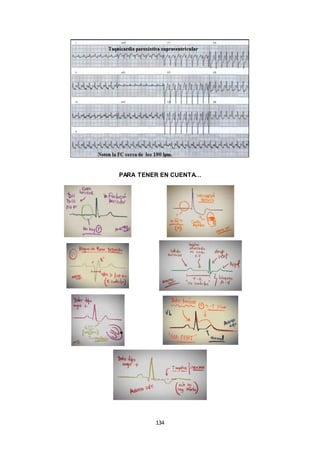
Este documento presenta un resumen de las clases teóricas de cardiología impartidas por el Dr. Rey. Incluye temas como el electrocardiograma normal, cardiopatías y valvulopatías como la estenosis mitral, endocarditis, hipertensión arterial, insuficiencia cardíaca, infarto agudo de miocardio y arritmias. Explica los signos y síntomas, exámenes complementarios y tratamiento de cada una de estas patologías cardíacas.