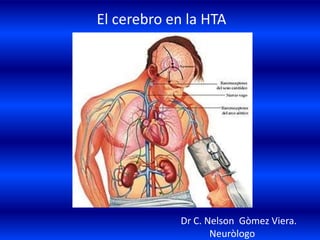
El documento resume los principales conceptos relacionados con la hemodinámica cerebral y la hipertensión arterial. Explica que el flujo sanguíneo cerebral se mantiene constante a través de la autorregulación vascular, aunque la presión arterial sistémica varíe moderadamente. También describe los mecanismos de la encefalopatía hipertensiva y los factores de riesgo más importantes para el accidente cerebrovascular, incluida la hipertensión arterial. Finalmente, resalta que el tratamiento adecuado de la presión arterial reduce signific