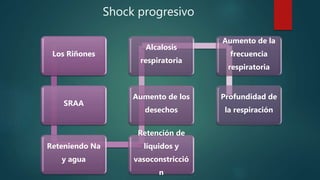
Este documento proporciona una descripción general del choque circulatorio. Define el choque como una inadecuada perfusión de tejidos que no satisface las demandas metabólicas. Explica las diferentes etiologías, mecanismos, clasificaciones y etapas del choque, así como los enfoques de diagnóstico y tratamiento inicial, incluida la importancia del soporte ventilatorio, la resucitación con fluidos y la administración de agentes vasoactivos.