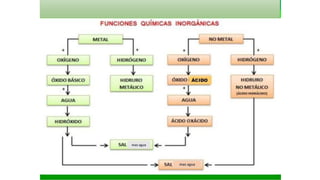
El documento aborda la clasificación de sustancias en ácidos y bases, su presencia en la vida cotidiana y su relevancia en conservación y restauración. Explica la formación de ácidos y bases a partir de óxidos y la teoría de ácidos y bases según diferentes autores. También destaca la importancia del pH en la preservación de documentos gráficos dañados por tintas ferrogálicas.







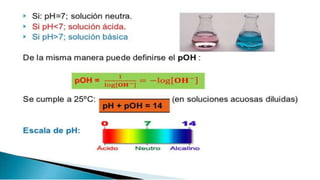
![Concepto de pH
Para llegar al concepto de pH es necesario revisar el llamado
equilibrio químico del agua. El agua es una sustancia anfótera, lo que
quiere decir que se comporta como ácido y como base mediante un
equilibrio de aparición y desaparición de iones OH- y H3O+
La siguiente lámina presenta la ecuación de equilibrio de la “reacción”
del agua con el agua para dar los iones correspondientes.
Los corchetes [OH-] y [H3O+] indican concentración de esos iones o
concentración de cualquier entidad química en una ecuación de
equilibrio.](https://image.slidesharecdn.com/cidosybases-151208012155-lva1-app6891/85/aCidos-y-bases-9-320.jpg)