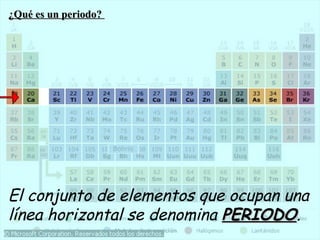
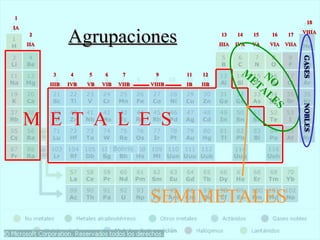
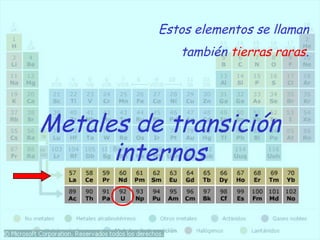
El documento describe la evolución de la Tabla Periódica de los Elementos desde su creación por Mendeleev y Meyer en el siglo XIX hasta su forma moderna. Resalta cómo Mendeleev ordenó los elementos por masa atómica y predijo propiedades de elementos aún desconocidos, lo que validó su tabla. Más tarde, Moseley reorganizó los elementos por número atómico. La tabla clasifica elementos en períodos y grupos con propiedades similares.