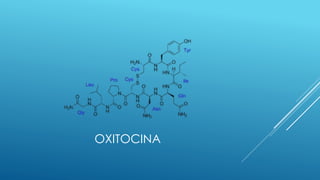
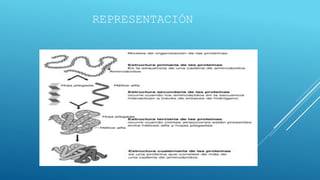
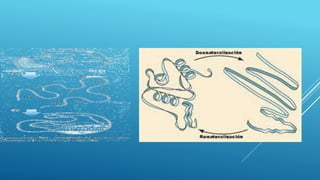
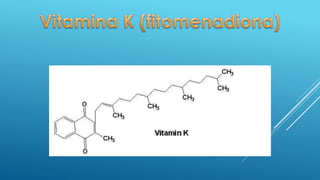
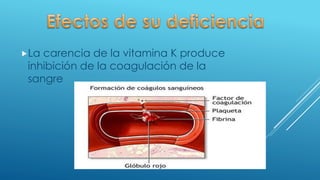
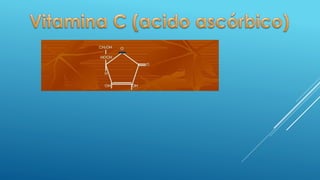
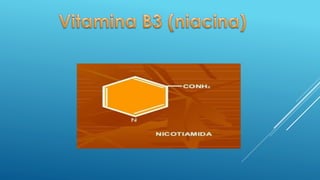
El documento define las proteínas y vitaminas, describiendo sus componentes, funciones y deficiencias. Las proteínas están compuestas de aminoácidos unidos por enlaces peptídicos. Cumplen funciones estructurales, enzimáticas y de transporte. Las vitaminas son compuestos orgánicos necesarios en pequeñas cantidades para el metabolismo normal. Se dividen en liposolubles como la A, D, E y K, e hidrosolubles como la C y el complejo B. Su deficiencia causa enfermedades como el escorbuto y el