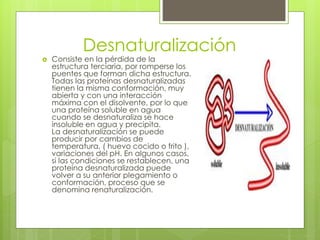
Las proteínas son macromoléculas esenciales compuestas por aminoácidos que desempeñan funciones vitales en los seres vivos, incluyendo estructuras celulares y funciones metabólicas. Su estructura se clasifica en cuatro niveles: primaria, secundaria, terciaria y cuaternaria, cada uno determinando su forma y función. La desnaturalización de una proteína implica la pérdida de su estructura terciaria, lo que puede afectar su solubilidad y actividad biológica.