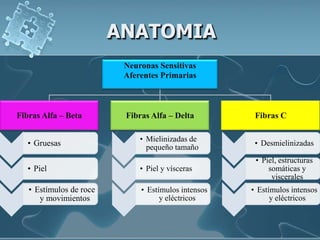
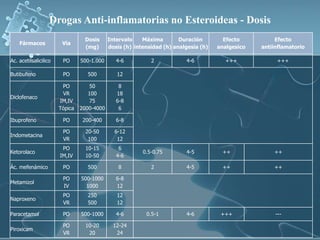
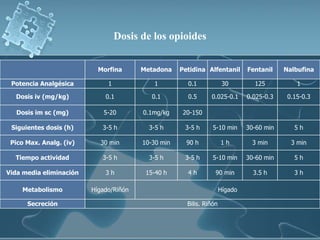
Este documento resume la definición, historia, anatomía y clasificación del dolor. Define el dolor como una sensación desagradable asociada con daño tisular real o potencial. Explora la historia del estudio del dolor desde la antigüedad hasta el desarrollo de centros multidisciplinarios para el tratamiento del dolor en el siglo XX. Describe la anatomía de los nociceptores y las vías del dolor en el sistema nervioso. Finalmente, clasifica el dolor por duración, intensidad, localización y cualidad.