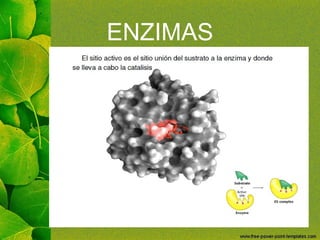
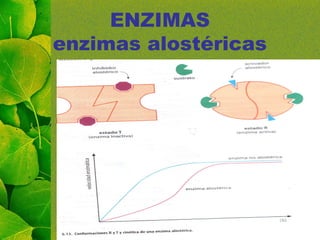
Este documento trata sobre las enzimas. Explica que las enzimas son proteínas que aceleran las reacciones químicas uniéndose específicamente a sus sustratos. También menciona las excepciones de las ribozimas, que no son proteínas sino ARN. Además, describe las características y propiedades de las enzimas, los mecanismos de acción, factores que influyen en su actividad, tipos de inhibición enzimática y regulación de la actividad enzimática. Por último, introduce los conceptos de co