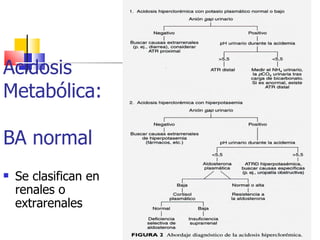
Este documento describe el equilibrio ácido-base en el cuerpo. Explica que el pH sanguíneo normal es de 7.4 y se mantiene entre 6.8 y 7.8. Describe los mecanismos de amortiguación como la conversión de CO2 en bicarbonato y la respuesta respiratoria y renal. También cubre las acidosis y alcalosis metabólicas, incluidas sus causas, respuestas compensatorias y clasificaciones.

![Equilibrio Acido-base.
Fisiología
pH es el logaritmo de la concentracíon del ión
hidrogenion expresada en milimoles por litro.
[H+] en sangre es alrededor de 40 x 10-9 eq/l, lo
cual es un pH de 7.4
El pH normal es entre 7.38 y 7.42
Los rangos compatibles con la vida varían entre 6.8 y
7.8. Este rango estrecho de pH es necesario para
función enzimática normal.](https://image.slidesharecdn.com/equilibrio-acido-base-120623054024-phpapp02/85/Equilibrio-acido-base-2-320.jpg)



![Primera línea de defensa
Es instantáneo
Minimiza pero no previene caída de pH
HCl + NaHCO3 ⇔ NaCl + H2CO3
ácido fuerte + sal ⇔ sal neutra + ácido
débil
Henderson – Hasselbach
pH = pK´ + log [HCO3] / [CO2]](https://image.slidesharecdn.com/equilibrio-acido-base-120623054024-phpapp02/85/Equilibrio-acido-base-6-320.jpg)















![Formulas
pH = pK´ + log base
ácido
Excresión neta ácido = UAMV+UATV-UBCV
Osmolaridad calculada = 2 [Na+]+[glucosa]+[NU]
180 18
Brecha anionica = Na+ - (Cl- + HCO3-) (10 – 14 mEq/l)
B.osmolal = osmolaridad medida – osmolaridad
calculada (< 10 mo)
B. urinaria = Na+ + K+ - Cl-](https://image.slidesharecdn.com/equilibrio-acido-base-120623054024-phpapp02/85/Equilibrio-acido-base-25-320.jpg)