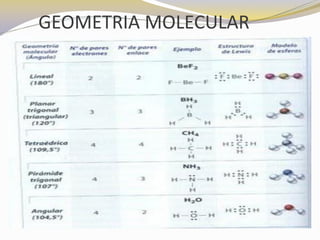
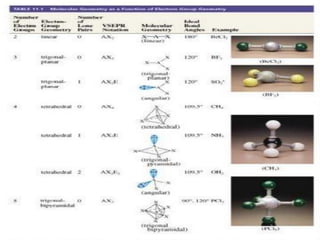
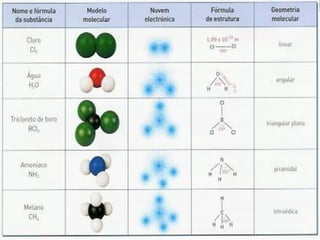
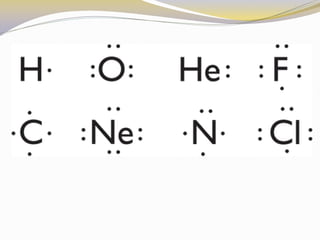
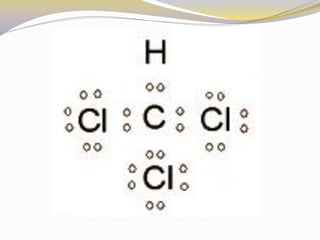
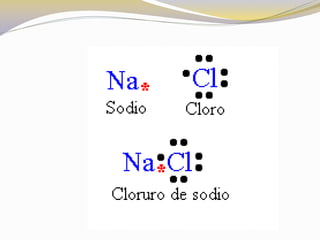
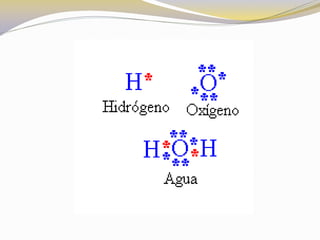
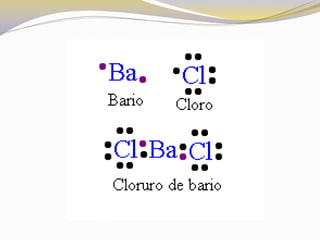
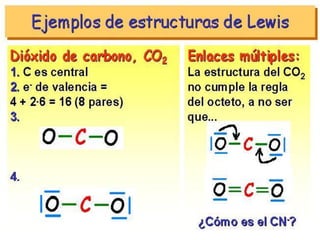
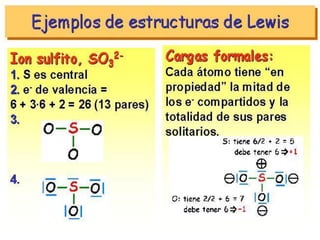
Este documento presenta reglas para la escritura de estructuras de Lewis. Primero, se identifica el átomo central según criterios como la cantidad, electrones desapareados y electronegatividad. Luego, se construye la estructura alrededor del átomo central contando electrones de enlace y de valencia. Finalmente, se acomodan electrones restantes siguiendo la regla del octeto, usando enlaces múltiples cuando sea necesario. También describe tipos de enlaces como dativos y múltiples, así como fuerzas intermoleculares