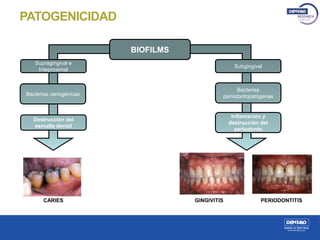
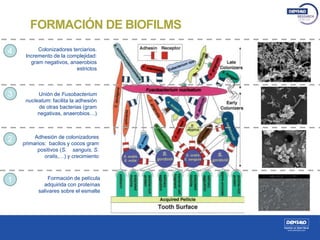
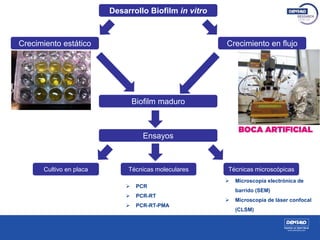
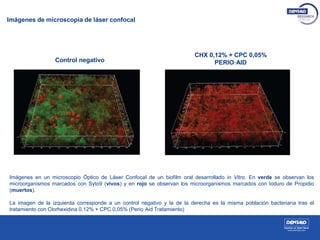
El estudio analiza los biofilms bucales, donde las bacterias se agrupan en matrices adheridas a superficies orales, siendo clave en patologías como caries y periodontitis. Se describe la formación de biofilms, sus propiedades, y la importancia de su estudio para la prevención de enfermedades bucales, utilizando técnicas de cultivo y microscopía para evaluar su resistencia y comportamiento. Métodos como PCR y microscopía confocal se emplean para examinar la eficacia de antisépticos en el tratamiento de biofilms.