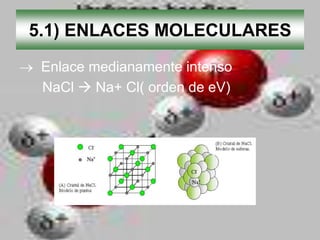
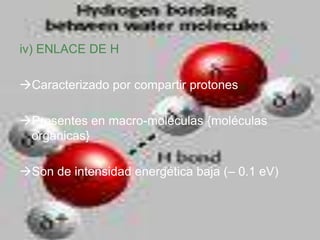
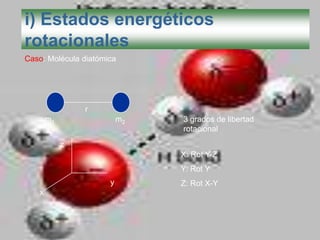
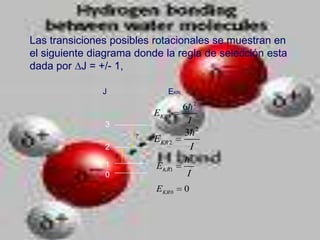
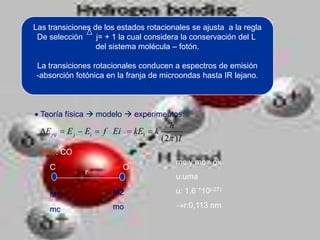
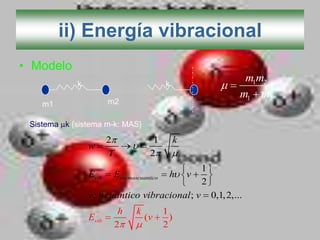
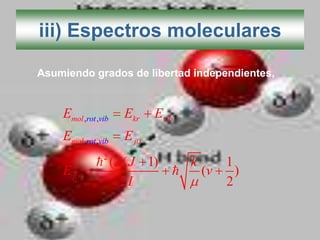
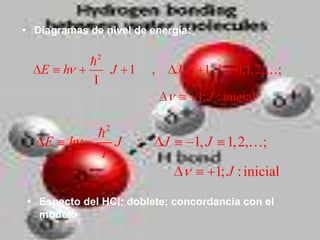
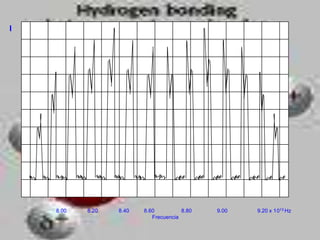
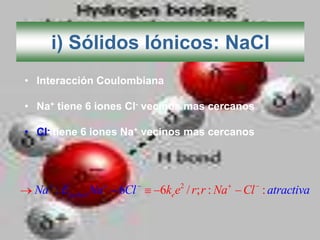
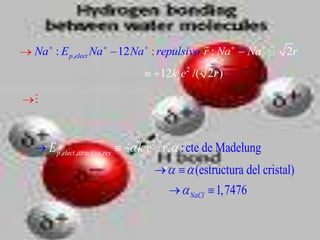
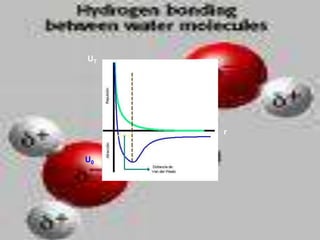
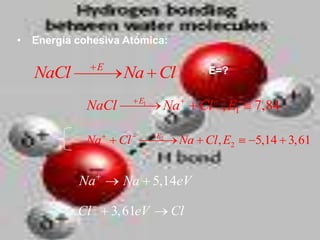
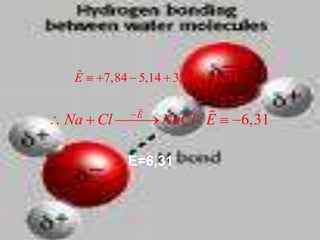
El documento describe los diferentes tipos de enlaces moleculares, incluyendo enlaces iónicos, covalentes, de Van der Waals y metálicos. También discute las energías rotacionales y vibracionales de las moléculas, y cómo estas propiedades se manifiestan en los espectros moleculares. Finalmente, cubre los enlaces en sólidos iónicos como NaCl, incluyendo su estructura cristalina y energía cohesiva.