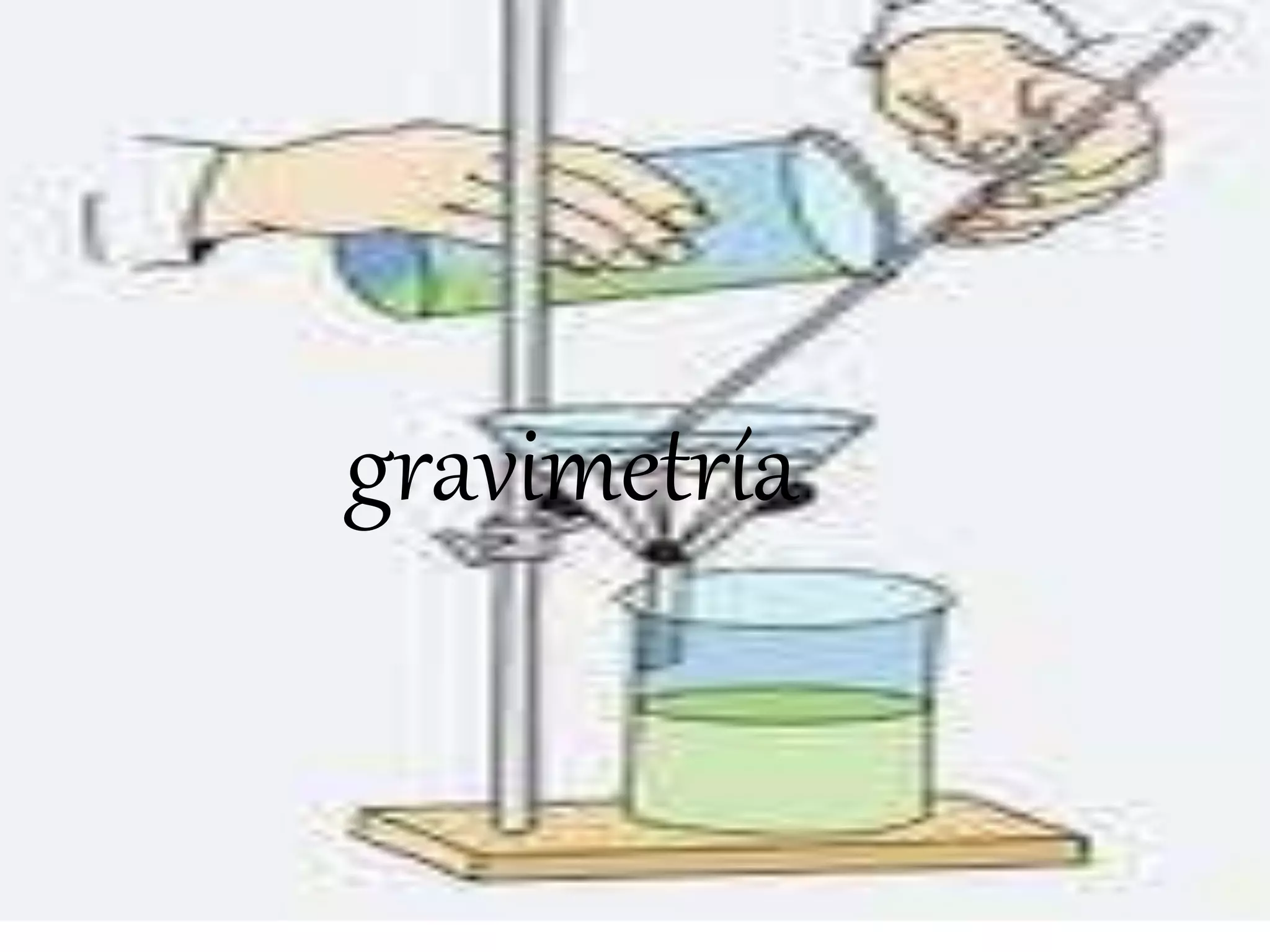
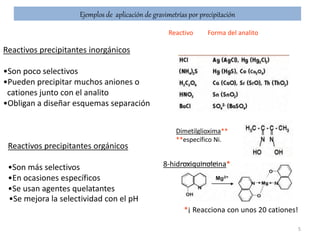
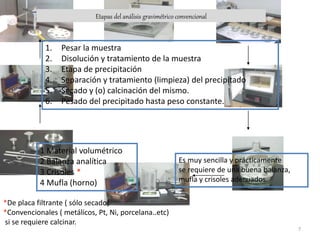
La gravimetría es un método analítico cuantitativo que determina la cantidad de sustancia en una muestra midiendo el peso de la misma. Los métodos gravimétricos incluyen la precipitación de un compuesto relacionado al analito, la volatilización del analito, o el depósito electrolítico del analito. A pesar de ser laboriosos, los métodos gravimétricos se siguen usando para el análisis de una o dos muestras o en análisis rutinarios que requieren solo precisión en la medición del peso.