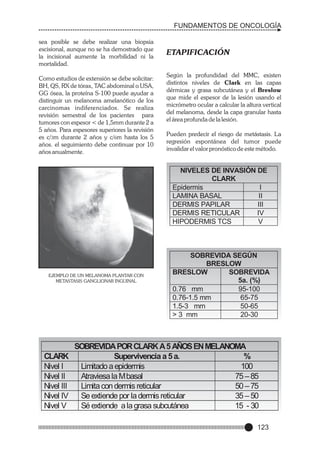
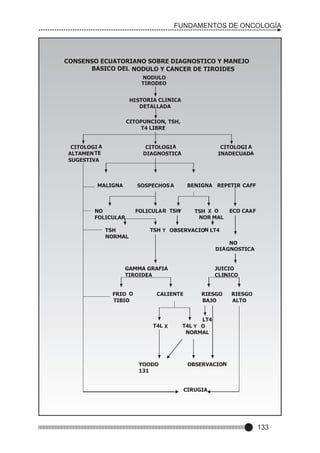
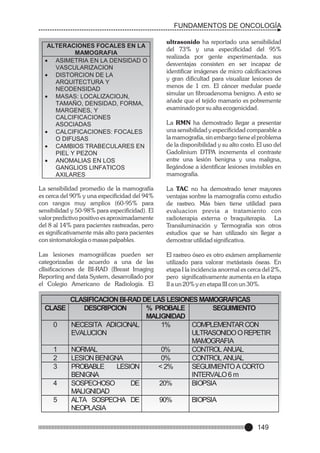
Este documento presenta un prólogo para el libro "Fundamentos de Oncología" escrito por el Dr. Edwin Cevallos Barrera. El prólogo describe el libro como una valiosa herramienta para estudiantes y médicos que aborda la historia y evolución del conocimiento sobre el cáncer. También destaca la importancia de la enseñanza médica continua a la luz de los avances en diagnóstico y tratamiento del cáncer. Finalmente, enfatiza la necesidad de un trato compasivo hacia los pacientes con cáncer.


















































![FUNDAMENTOS DE ONCOLOGÍA
tumores humanos, es lógico que se haya
utilizado muy frecuentemente en protocolos
de reemplazamiento genético. Al contrario
que en el caso de los oncogenes citado
anteriormente, es la pérdida de la función
normal de los genes supresores de tumores
(no la adquisición de una actividad
transformante dominante) lo que contribuye
al desarrollo neoplásico, siendo necesaria la
alteración de ambos alelos para que se
exprese el fenotipo transformado. Por tanto,
este tipo de alteración genética es el
candidato ideal para el empleo de técnicas de
reemplazo genético que pretenden transferir
una copia del gen normal a las células
tumorales y así restablecer una función
perdida. En la actualidad un buen número de
protocolos de terapia genética se basan en la
transferencia de p53 normal mediante
retrovirus y adenovirus recombinantes, o por
inyección directamente en los tumores de
ADN purificado. Un avance importante en
este campo ha sido e desarrollo de un tipo de
adenovirus que solamente se replica en
cé1ulas que contienen versiones mutadas de
p53, a las que termina matando.
En
protocolos activos de los que se tiene
suficiente información se ha llegado a
observar la disminución del tamaño de los
tumores en un 25% de los pacientes,
principalmente en casos de carcinoma
hepatocelular y carcinoma de pulmón
(NSLCC = no small lung cells carcinoma), sin
efecto secundario aparente. La limitación
principal de esta técnica es la falta de vectores
que permitan el tratamiento sistémico sin
provocar una respuesta inmune anti-vector
en los pacientes.
TERAPIA CON GENES QUE
ESTIMULAN LA SENSIBILIDAD A
FÁRMACOS CITOTÓXICOS (GENES
SUICIDAS)
Estos protocolos se basan en la transferencia a
las células tumorales de un gen cuyo producto
es capaz de metabolizar un fármaco inactivo y
convertirlo en un derivado tóxico que mata
las células en que se generó. En la actualidad
hay una serie de protocolos activos que
emplean principalmente dos sistemas
enzimáticos. La timidin quinasa derivada del
virus del herpes (HSV-tk), que genera
derivados trifosfato del ganciclovir que
inhiben la sintesis de ADN, y la citosina
deaminasa (CD) derivada de la Escherichia
coli, que convierte la 5-fluorocitosina (5-FC)
en 5-fluorouracilo (5-FU), un conocido
agente quimioterápico. Un componente
importante en el mecanismo de acción
antitumoral de estas técnicas radica en la
difusión de los productos citotóxicos de las
células en que se generaron a las células que
las rodean (el denominado ibystander effects,
en la bibliografía en inglés o camicase). De
este modo, el número de células tumorales
destruidas es superior al de células que
recibieron el gen responsable de ]a
conversión metabólica de los productos
citotóxicos.
El gen de la citosina deaminasa se ha utilizado
principalmente en protocolos diseñados para
el tratamiento de metástasis hepáticas de
tumores gastrointestinales, empleando el
promotor del gen de la alfa-fetoproteina o del
antigeno carcinoembrionario (CEA) para
favorecer la expresión en el hígado. Aunque
l o s re s u l t a d o s f u e r o n i n i c i a l m e n t e
alentadores, el mayor problema de este tipo
de protocolo es el desarrollo de resistencia a
5-FU por las células tumorales, que ocasiona
una reducción significativa del efecto
inhibitorio del desarrollo tumoral. En la
actualidad, el empleo del gen CD ha sido
prácticamente abandonado, aunque se
realizan esfuerzos a nivel pre-clínico para
combinar protocolos basados en la
transferencia del gen CD y otras modalidades
de terapia genética, que se mencionaran más
adelante, diseñadas especialmente para
modular la resistencia a agentes quimio
terapéuticos.
El gen HSV-tk se ha utilizado, y se sigue
utilizando, en el tratamiento de varios tipos de
tumores, incluyendo tumores primarios
localizados como gliomas, mesoteliomas o
carcinomas de próstata, metástasis hepáticas
y peritoneales. En la actualidad hay decenas
de protocolos activos basados en el uso del
gen HSV-tk. En general los resultados de los
29](https://image.slidesharecdn.com/fundamentosdeonc987654321-131120142508-phpapp02/85/Libro-de-Fundamentos-de-oncologia-55-320.jpg)


![DR. EDWIN CEVALLOS BARRERA
en contra de la utilización clínica de técnicas
de terapia genética haya sido el que los
protocolos se hayan usado sin rigor científico
suficiente, más motivados por ]as prisas de
muchos de haber sido los primeros en
alcanzar la gloria en este campo, que como
resultado de la aplicación seria de
conocimientos básicos sólidamente
demostrados acerca de la respuesta del
organismos humano a tratamientos de
eficacia contrastada a nivel pre-clínico, en
modelos animales relevantes. El análisis
critico de la información presentada
brevemente en esta revisión y de los
resultados detallados publicados cada vez
más frecuentemente en revistas
especializadas deja claro que la acusación de
falta de rigor científico esta justificada, pero
solo en parte.
No se puede devaluar
automáticamente la cantidad enorme de
experimentos realizados a nivel molecular y
celular o en modelos animales. La
investigación básica se ha llevado a cabo, y se
seguirá llevando a cabo, con el rigor científico
apropiado. Es la aplicación al organismo
humano la que se realizó sin la información
suficiente, y cuyas expectativas han resultado
en la situación actual de pesimismo casi
generalizado.
L a recomendación de los exper tos
consultados por los N.I.H. es, por tanto,
tremendamente lógica, concentrar más
esfuerzos en comprender los mecanismos
moleculares del cáncer (en sus múltiples
manifestaciones) y desarrollar o mejorar
técnicas de transferencia de genes,
disminuyendo por ahora el énfasis en las
aplicaciones terapéuticas.
En algunos
círculos de investigadores básicos y clínicos
estas recomendaciones se han interpretado
como una prohibición de la terapia genética
del cáncer, pero ésta no es una visi—n
realista de las mismas. La lectura detenida de
los documentos redactados por los dos
comités asesores de los N.I.H. indica que lo
que se pretende no es parar de golpe la
terapia genética del cáncer, sino cambiar su
rumbo, sugiriendo áreas que necesitan
desarrollo y directrices para la definición y
consecución de objetivos a mediano y largo
32
plazo. Se trata de disminuir el nivel excesivo
de optimismo que se había creado de forma
injustificada, y de replantear las expectativas
futuras tanto de la comunidad científica
como de la población en general para evitar
caer un sueños imposibles.
El desarrollo y la mejora de vectores para la
transferencia de genes aparece como un área
de investigación cuya importancia es critica
para el futuro de la terapia genética del
cáncer. En concreto, la investigación debe
centrarse en:
(a) Modificar los vectores de origen viral para
reducir su toxicidad e inmuno genicidad.
(b) Aumentar la eficiencia de los vectores de
origen no vírico para la transferencia
genética.
(c) Incrementar la especificidad de los
vectores por las células o tejidos diana y.
(d) Controlar los niveles y la duración de la
expresión de los genes en las cé1ulas diana
una vez transferidos.
En realidad, lo ideal seria poder llevar a cabo
toda esta línea de investigación en humanos,
pero no es posible por razones obvias de tipo
ético. Por tanto, una parte importante de la
investigación futura debe incluir el
establecimiento de modelos animales nuevos
que reflejen lo más fielmente posible la
situación humana. Sistemas experimentales
basados en el uso de animales trans génicos
en sus diferentes modalidades que podrían
ser modelos ideales para predecir no solo si
una estrategia determinada seria factible y
eficaz, sino también para definir las
condiciones óptimas en que se podría aplicar
en humanos.
Naturalmente el desarrollo de nuevos
vectores y el establecimiento de nuevos
modelos animales van a llevar tiempo.
Mientras tanto, la mejor opción para el
avance de la terapia genética del cáncer
podría ser la puesta en marcha de protocolos
clínicos en que se combinen aspectos de
terapia genética suficientemente contrastados
a nivel pre-clínico con otras modalidades de
tratamiento contra el cáncer. Existen datos
que apoyan el uso de protocolos de terapia
genética combinada: se ha demostrado un](https://image.slidesharecdn.com/fundamentosdeonc987654321-131120142508-phpapp02/85/Libro-de-Fundamentos-de-oncologia-58-320.jpg)























































































![DR. EDWIN CEVALLOS BARRERA
WB Saunders, 1996:143.
6. [ R i s k f a c t o r s a s s o c i a t e d w i t h
etiopathogenesis of non-melanoma ski n
cancer in Valencia] Morales Suarea-Varela
MM, Llopis Gonzalez A, Cejudo Ferragud
AI An Med Interna; 13(4): 171-7 1996
8. Sun and skin cancer. Role of the
pediatrician Albisu Andrade Y An Esp
Pediatr; 46(2):111-3 1997
9.Ferrandiz C,Jose Fuente M . Skin cancer in
patients submitted to organ
transplantation: a growing problem] Med
Clin (Barc); 116(6):217-9 2001
10.Primary esophageal melanoma Benito
Sanchez FG, Jimenez Perez C, Gonzalez
Arias R, Saez Garcia MA, Garcia
Benavente A, Montero Vazquez JM
Gastroenterol Hepatol; 21(6): 283-6 1998
11.The role of SPARC gene in tumorigenic
capacity of human melanoma cells]
Ledda MF, Adris S, Bover L, Bravo AL,
Mordoh J, Podhajcer OL Medicina (B
Aires); 56(1): 51-4 1996.
12.MALDONADO, S. Y COL, FACTORES
DE RIESGO EN EL CÁNCER DE PIEL.,
2000, MEDICINA PREVENTIVA Y
SALUD PÚBLICA
No pienso en el futuro,
pues llegará en su momento
Albert Einstein
126](https://image.slidesharecdn.com/fundamentosdeonc987654321-131120142508-phpapp02/85/Libro-de-Fundamentos-de-oncologia-152-320.jpg)



















































































































































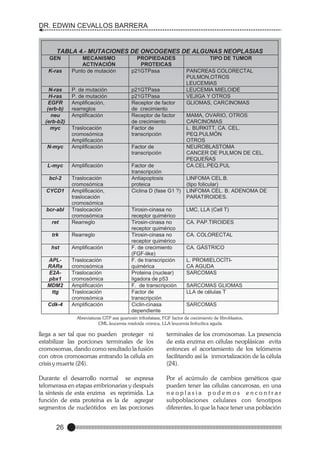
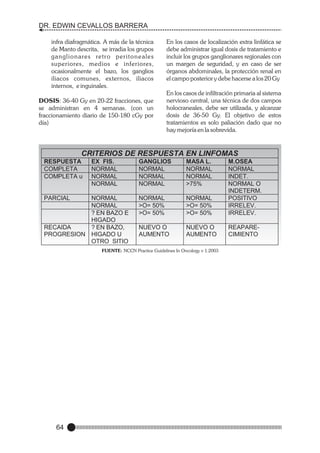
![FUNDAMENTOS DE ONCOLOGÍA
CLÍNICA
MANIFESTACIONES CLINICAS
DE HIPERCALCEMIA
RELACIONADO A CANCER
GENERAL:
DESHIDRATACIÓN PÉRDIDA DE
PESO
ANOREXIA
PRURITO
POLIDIPSIA
NEUROMUSCULAR:
FATIGA, LETARGIA
DEBILIDAD MUSCULAR
HIPORREFLEXIA CONFUSIÓN
PSICOSIS
CRISIS CONVULSIVAS
OBNUBILACIÓN
COMA.
GASTROINTESTINAL:
NÁUSEA VÓMITO
CONSTIPACIÓN
ÍLEO.
NEFROUROLOGICAS:
POLIURIA INSUFICIENCIA RENAL.
CARDIACO:
BRADICARDIA INTERVALO -PRPROLONGADO
ACORTAMIENTO DEL INTERVALO
–QT-, ONDA T AMPLIA
ARRITMIA ATRIAL o VENTRICULAR
TRATAMIENTO
Prevención
Los individuos que corren el riesgo de
desarrollar hipercalcemia pueden ser los
primeros en reconocer los síntomas. Se les
deberá asesorar en las formas como se
manifiesta mas frecuentemente (vea la
sección sobre manifestaciones de la
hipercalcemia, arriba) y se les deberá proveer
de pautas aconsejándoles cuando buscar
intervención profesional. Entre las medidas
de prevención se encuentran el asegurar un
consumo adecuado de fluidos (3-4 litros
[100-140 onzas de fluido] diarios si no ha sido
contraindicado) y el consumo de sal, control
de náusea y vómito, animar a los pacientes a
que caminen y a que se mantengan
generalmente en movimiento, poner atención
a episodios febriles y a usar cautelosamente, o
eliminar, fármacos que puedan complicar el
control.
Aunque los intestinos desempeñan una
función en la homeostasis normal de calcio, la
absorción disminuye por lo general en
individuos con hipercalcemia, haciendo
innecesaria la restricción de calcio dietética.
Manejo de hipercalcemia
El tratamiento asintomático de la
hipercalcemia se enfoca primero a corregir la
deshidratación y a aumentar la excreción de
calcio renal, seguido de un tratamiento
especifico hipocalcémico con agentes que
inhiben la absorción ósea (p. ej., calcitonina,
bisfosfonatos, nitrato de galio y plicamicina).
El tratamiento definitivo es el que trata de
manera efectiva la malignidad subyacente a
la hipercalcemia.
La magnitud de la hipercalcemia es por lo
común la base por la cual se determina la
necesidad de tratamiento. El tratamiento
hipocalcémico inmediato agresivo se
garantiza en los pacientes con calcio sérico
total corregido de más de 14 mg/dL (>7
mEq/L o 3.5 mmol/L) (vea la sección sobre
evaluación de laboratorio que se encuentra
en la descripción de este documento). En los
pacientes con concentraciones de calcio
sérico total corregidas entre 12-14 mg/dL (6-7
mEq/L o 3.0-3.5 mmol/L), las
manifestaciones clínicas deberán guiar el tipo
de terapia y la urgencia con la que se
implementa.[5] La respuesta al tratamiento se
indica por medio de la resolución de síntomas
atribuibles a la hipercalcemia y por medio de
la reducción de concentraciones de calcio
sérico y por excreción de calcio urinario y de
hidroxiprolina.
El tratamiento agresivo por lo general no se
indica para pacientes con hipercalcemia leve
(calcio sérico total corregido <12 mg/dL [<6
mEq/L o 3.0 mmol/L]). Las decisiones claras
sobre el tratamiento son problemáticas, sin
embargo, para pacientes con hipercalcemia
287](https://image.slidesharecdn.com/fundamentosdeonc987654321-131120142508-phpapp02/85/Libro-de-Fundamentos-de-oncologia-313-320.jpg)
![DR. EDWIN CEVALLOS BARRERA
leve y síntomas coexistentes del sistema
nervioso central, especialmente, para
pacientes jóvenes en los que la hipercalcemia
es por lo general mejor tolerada. Es muy
importante evaluar otras causas de la
alteración de la función del sistema nervioso
central antes de atribuirla únicamente a la
hipercalcemia.
El tratamiento hipocalcémico puede
proporcionar una mejoría marcada en los
síntomas aflictivos. La poliuria, polidipsia,
síntomas del sistema nervioso central, náusea
y vómito, y estreñimiento tienen una mayor
probabilidad de ser controlados con éxito que
la anorexia, malestar y fatiga. El control del
dolor puede ser mejorado para algunos
pacientes que logran normocalcemia. La
terapia efectiva para la disminución de calcio
por lo general mejora los síntomas, aumenta
la calidad de la vida y puede permitir que los
pacientes sean controlados en una situación
de atención médica subaguda, ambulatoria o
doméstica.
Después de haber logrado la normocalcemia,
el calcio sérico y el urinario deberán ser
monitorizados seriadamente con la
frecuencia determinada por la duración
anticipada de respuesta en cualquier régimen
hipocalcémico en particular.
Hipercalcemia leve
(calcio sérico total corregido <12 mg/dL
[<6 mEq/L o 3.0 mmol/L])
La hidratación seguida de observación es una
opción para pacientes asintomáticos con
tumores que tienen la posibilidad de
responder a tratamiento antineoplásico (p.
ej., linfoma, cáncer del seno, cáncer ovárico,
carcinoma de cabeza y cuello y mielomatosis)
si el tratamiento está por ser implementado.
En pacientes sintomáticos o cuando se espera
que la respuesta del tumor ocurra lentamente,
la terapia hipocalcémica deberá ser
implementada para controlar los síntomas y
estabilizar la condición metabólica de los
pacientes. Las intervenciones auxiliares
adicionales deberán ser dirigidas al control de
288
la náusea y vómito, alentar movilidad,
atención a episodios febriles y uso mínimo de
medicamentos sedantes.
Hipercalcemia moderada a grave
(calcio perico total corregido igual a 12-14
mg/dL [6-7 mEq/L o 3.0-3.5 mmol/L])
Rehidratación
La rehidratación es el primer paso esencial en
el tratamiento de hipercalcemia moderada o
grave. Aunque menos del 30% de los
pacientes logran normocalcemia con
hidratación sola, el reabastecimiento de
fluido extracelular, la restauración del
volumen intravascular y la diuresis salina son
fundamentales en la terapia inicial. La
rehidratación adecuada puede requerir 30006000 ml de cloruro de sodio 0.9% para una
inyección (solución salina normal) en las
primeras 24 horas para restaurar el volumen
del fluido. La restauración del volumen
normal de fluido extracelular incrementara la
excreción diaria de calcio urinario en 100-300
mg. La mejoría clínica de la condición mental,
la nausea y el vomito, se hace aparente por lo
general en un lapso de 24 horas para la
mayoría de los pacientes; sin embargo, la
rehidratación es una intervención temporal.
Si no se anticipan terapias cito reductoras
(cirugía, radiación o quimioterapia), se tienen
que usar agentes hipocalcémicos para lograr
el control a largo plazo.
Diuréticos
Los diuréticos tiacídicos son contraindicados
debido a que aumentan la absorción tubular
de calcio renal y pueden agravar la
hipercalcemia. Los diuréticos del asa (p. ej.,
furosemida, bumetanida y ácido etacrínico)
inducen la hipercalciuria al inhibir la
reabsorción de calcio en la rama ascendente
del asa de Henle, pero no deberán ser
administrados hasta que se logre la expansión
de volumen. De lo contrario, los diuréticos del
asa pueden exacerbar la pérdida de fluidos,
reduciendo aun mas la posibilidad de
eliminación de calcio. Debido a que la
eliminación de sodio y la de calcio están
estrechamente relacionadas durante la](https://image.slidesharecdn.com/fundamentosdeonc987654321-131120142508-phpapp02/85/Libro-de-Fundamentos-de-oncologia-314-320.jpg)

![DR. EDWIN CEVALLOS BARRERA
calcitonina en la retorsión ósea puede
prolongarse por la administración
concomitante de glucocorticoides y que
cuando este combinada con bisfosfonatos
puede acelerar el comienzo y la duración de la
respuesta hipocalcémica.
La calcitonina es por lo general bien tolerada;
entre los efectos adversos se encuentran
náusea leve, dolor transitorio abdominal de
calambres y rubor cutáneo. La calcitonina es
más útil dentro de las primeras 24-36 horas de
tratamiento de hipercalcemia grave y deberá
usarse en conjunto con agentes mas potentes
pero de acción más lenta.
Plicamicina
La plicamicina (también llamada
mitramicina) es un inhibidor de la síntesis del
osteoclasto de RNA. Se ha mostrado que
inhibe la retorsión ósea in vitro y es
clínicamente efectiva en la presencia o
ausencia de metástasis óseas. El comienzo de
la respuesta ocurre dentro de 12 horas
después de una sola dosis intravenosa de 2530 microgramos/kg de peso corporal
administrada ya sea en forma de infusión
corta de 30 minutos o mas larga. La respuesta
máxima, sin embargo, no ocurre sino hasta
48 horas después de la administración y
puede persistir por 3-7 días o más después de
la administración. Se pueden administrar
dosis repetidas para mantener el efecto
hipocalcémico de la plicamicina pero no
deberán ser administradas con una
frecuencia mayor de 48 horas para
determinar el efecto máximo de disminución
de calcio producido por dosis previas. Dosis
múltiples pueden controlar la hipercalcemia
por varias semanas, pero generalmente
ocurre hipercalcemia de rebote sin
tratamiento definitivo contra la malignidad
subyacente. Aunque el tratamiento de una
sola dosis para hipercalcemia es por lo
general bien tolerado, produciendo pocos
efectos adversos, se ha informado de
disfibrinogenemia, y nefrotoxicidad después
de dosis únicas (20-25 microgramos/kg).
La administración intravenosa rápida esta
290
asociada con náusea y vómito. Las dosis
elevadas y las dosis repetidas predisponen a
trombocitopenia, un trastorno cualitativo de
las plaquetas que puede asociarse con una
diátesis de sangrado, aumento pasajero de
transaminasas hepáticas, nefrotoxicidad
(menos eliminación de creatinina, aumento
de creatinina perica y BUN, deshecho de
potasio y proteinuria), hipofosfatemia, un
síndrome que se asemeja a la influenza,
reacciones dermatológicas y estomatitis.
Bifosfonatos
Los bifosfonatos son una de las alternativas
farmacológicas mas efectivas para el control
de la hipercalcemia. Se unen a hidroxiapatita
en hueso calcificado, haciéndolo resistente a
la disolución hidrolítica por medio de
fosfatasas, inhibiendo de esta manera tanto la
retorsión ósea normal como la anormal. El
tratamiento por bisfosfonatos reduce el
número de osteoclastos en sitios en donde
hay retorsión ósea activa y pueden prevenir
expansión osteoclástica al inhibir la
diferenciación de sus precursores de
macrófagos -monocitos. Los bisfosfonatos
tienen efectos variables en otros aspectos de
la remodelación ósea tales como la nueva
formación de hueso y mineralización. Con el
uso prolongado de etidronato, pueden ocurrir
osteomalacia y fracturas patológicas. Por lo
contrario, el clodronato, el pamidronato y el
alendronato son 10, 100 y 1000 veces,
respectivamente, inhibidores mas potentes de
retorsión ósea que el etidronato y son
clínicamente útiles en dosis que tienen menor
posibilidad de afectar adversamente la nueva
formación ósea y la mineralización.[33-36]
Los médicos clínicos deberán notar que
varios bisfosfonatos pueden ser útiles en el
tratamiento de hipercalcemia de neoplasia
maligna; sin embargo, únicamente el
etidronato y el pamidronato están aprobados
en los Estados Unidos para esa indicación.
En comparación al etidronato el cual requiere
administración diaria por 3 o mas días, el
pamidronato se administra una vez en un
periodo de 4-24 horas (dosis de 60 mg) o en
un periodo de 24 horas (dosis de 90 mg). Con
respecto a la reducción de calcio sérico y a la](https://image.slidesharecdn.com/fundamentosdeonc987654321-131120142508-phpapp02/85/Libro-de-Fundamentos-de-oncologia-316-320.jpg)
![FUNDAMENTOS DE ONCOLOGÍA
duración de la respuesta hipocalcémica, el
pamidronato (60 mg administrados
intravenosamente como una dosis sola en un
periodo de 24 horas) ha demostrado ser más
efectivo que el etidronato a 7.5 mg/kg de peso
corporal por día administrado en un periodo
de 2 horas como una infusión intravenosa
diaria por 3 días consecutivos.
La dosis y horario de administración óptimos
de pamidronato no han sido establecidos; sin
embargo, la selección de la dosis puede ser
indicada por la gravedad de la hipercalcemia.
En el tratamiento de la hipercalcemia
moderada (calcio perico corregido <13.5
mg/dL, <6.75 mEq/L o <3.37 mmol/L) 60
mg de pamidronato administrados
intravenosamente en un periodo de 24 horas
han demostrado ser tan efectivos como 90
mg.[46] Para los niveles de calcio sérico >/=
13.5 mg/dL, 90 mg administrados en un
periodo de 24 horas han demostrado ser
seguros y algo mas efectivos que 60 mg
administrados con el mismo horario de
administración.
El comienzo de los efectos del pamidronato se
hace aparente en 3-4 días, presentando
efectos máximos a los 7-10 días después de
comenzado el tratamiento. La duración del
efecto puede persistir por 7-30 días. Entre los
efectos adversos se encuentran aumento
pasajero de la temperatura de pocos grados
(1-2 grados C) que ocurren típicamente en
24-36 horas después de la administración y
persisten hasta por 2 días en hasta 20% de los
pacientes. Otros bifosfonatos (excepto el
clodronato) también pueden producir
aumento pasajero de la temperatura; la
incidencia en el aumento de la temperatura,
náusea, anorexia, dispepsia y vómito puede
incrementarse por la rapidez de la
administración. Un nuevo ataque de
hipofosfatemia e hipomagnesemia puede
ocurrir; las anormalidades que ya estaban
presentes en los mismos electrolitos pueden
agravarse con el tratamiento. El calcio sérico
puede excederse por debajo de la escala
normal, y puede causar hipocalcemia
(generalmente asintomática). La insuficiencia
renal se ha reportado solamente después de
inyección rápida de etidronato y clodronato,
pero se deberá evitar una administración
rápida con todos los bisfosfonatos. La
administración intravenosa de pamidronato
ha sido asociada con respuestas de fase
aguda, incluyendo recuentos
transitoriamente menores de linfocitos
periféricos. Se ha informado de reacciones
locales (tromboflebitis, eritema y dolor) en el
sitio de infusión.
La calcitonina y la plicamicina tienen un
efecto hipocalcémico mas rápido que los
bisfosfonatos; sin embargo, el pamidronato
tiene varias ventajas sobre las terapias no
basadas en bisfosfonatos. En comparación
con la plicamicina, las tasas de respuestas son
mayores entre los pacientes tratados con
pamidronato. El pamidronato reduce con
mayor frecuencia las concentraciones de
calcio sérico a índices normocalcémicos que
la calcitonina o la plicamicina. Además, el
efecto hipocalcémico del pamidronato esta
relacionado con la dosis y se sostiene después
de administración repetida y por lo general
persiste por periodos mas largos que los
producidos por terapias a base de calcitonina
o plicamicina. Con respecto a la seguridad, el
pamidronato no tiene los efectos tóxicos
renales, hepáticos y de plaquetas asociados
con la plicamicina.
Nitrato de galio
El nitrato de galio fue desarrollado como
agente antineoplásico que por coincidencia
demostró producir un efecto hipocalcémico.
Se ha demostrado que es superior al
etidronato en el porcentaje de pacientes que
alcanzan normocalcemia y en la duración de
normocalcemia. Entre las desventajas de su
uso se encuentran un horario contínuo de
infusión intravenosa por 5 días (200
mg/metro cuadrado de la superficie
corporal/DIA) y el potencial de
nefrotoxicidad, particularmente cuando se
usa concurrentemente con otros fármacos
potencialmente nefrotoxicos (p. ej.,
aminoglucósidos y anfotericina B) (Hoja
informativa del paquete Fujisawa-Ganite,
1991). El nitrato de galio también se ha
administrado por inyección subcutánea
291](https://image.slidesharecdn.com/fundamentosdeonc987654321-131120142508-phpapp02/85/Libro-de-Fundamentos-de-oncologia-317-320.jpg)

![FUNDAMENTOS DE ONCOLOGÍA
contra de la irradiación ionizante y la
quimioterapia alquilante. La amifostina
suprime la secreción de PTH, inhibe la
retorsión ósea e interfiere con la reabsorción
renal tubular de calcio. La hipocalcemia se
reportó como una reacción adversa en los
primeros estudios clínicos, pero la amifostina
puede tener algo de efectividad en el manejo
de la hipercalcemia relacionada con el cáncer.
El acetato de octreotide ha mostrado alguna
actividad en la hipercalcemia relacionada con
el cáncer en dos informes anecdóticos. Se
piensa que la octreotida interfiere con la
secreción ectopia de PTH u hormonas
parecidas a la paratiroidea. La octreotida
puede ser útil cuando otras intervenciones
fracasan o son inapropiadas. En un informe,
la octreotida fue administrada en 150
microgramos subcutáneamente tres veces al
día durante seis días. La normocalcemia
ocurrió dentro de 24 horas después de la
primera dosis y persistió hasta un día después
de haberse discontinuado la octreotida.
El manejo farmacológico en el futuro es
probable que combine inhibidores
osteoclásticos con terapia citotóxica o
endocrina. Los estudios que emplean
bisfosfonatos orales en combinación con
quimioterapia sistémica en pacientes con
cáncer del seno avanzado demostraron
requisitos reducidos analgésicos y de
radioterapia, menos complicaciones y menos
progresión de la enfermedad en el grupo de
estudio.
Pronóstico
La hipercalcemia por lo general se desarrolla
como una complicación tardía de la
malignidad; su aparición tiene un significado
pronóstico grave. Todavía no esta claro, sin
embargo, si la muerte esta relacionada con
una crisis hipercalcémica (hipercalcemia no
controlada o recurrente progresiva) o con
enfermedad avanzada. En la actualidad los
agentes hipocalcémicos disponibles tienen
poco efecto en la disminución de las tasas de
mor talidad entre los pacientes con
hipercalcemia de neoplasia maligna. Aunque
existe desacuerdo entre los investigadores
que han evaluado la supervivencia entre
pacientes con hipercalcemia relacionada con
cáncer, se ha observado que el 50% de los
pacientes con hipercalcemia mueren en un
lapso de 1 mes y el 75% en un lapso de 3
meses después de empezado el tratamiento
hipocalcémico. En el mismo estudio, se
encontró que los pacientes con hipercalcemia
que respondieron al tratamiento
antineoplásico especifico presentaron una
ventaja en la supervivencia ligeramente
mayor sobre los que no respondieron. Entre
otras variables pronósticas que mostraron
una correlación con una mejor duración de
supervivencia, se encuentran la
concentración de albúmina sérica
(correlación directa), concentraciones de
calcio sérico después de tratamiento
(correlación inversa), y la edad (correlación
inversa). En contraste con su modesto efecto
en la supervivencia, Ralston y colaboradores
observaron tasas de respuesta marcadas pero
diferenciales después de los tratamientos
hipocalcémicos como un factor del tipo de
síntoma. Las mejorías mas substanciales
ocurrieron en los síntomas relacionados con
las funciones renales y del sistema nervioso
central, náusea y vómito y estreñimiento. Los
síntomas de anorexia, malestar y fatiga
mejoraron, pero menos completamente.[8]
REFERENCIAS
BIBLIOGRAFICAS
1) De Vita VT: Cancer, Principles and
Practice of Oncology 1997. 5ta ED. Ed
Lippincot-Raven, pag: 2486-2493
2) Moosa AR, Stephen C: Comprehensive
textbook of Oncology 1991, 2da ED. Ed
Williams and Wilkins. 1679-1682
3) Tintinalli JE, Ruiz E: Emergency Medicine
1996. 4ta ED. Ed International. Pag 133135
4) Manual of Medical Therapeutics of
Departament of Medicine, Washington
University 1996, 9a ED. Ed Masson. Pag
583-89.
1. Coward DD: Hypercalcemia knowledge
assessment in patients at risk of
293](https://image.slidesharecdn.com/fundamentosdeonc987654321-131120142508-phpapp02/85/Libro-de-Fundamentos-de-oncologia-319-320.jpg)