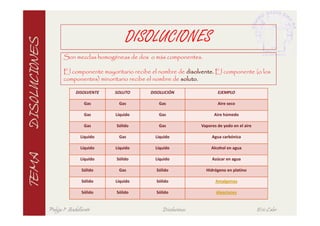
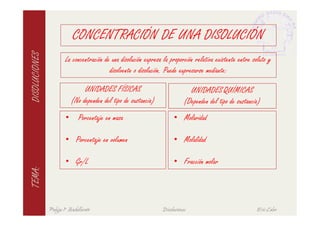
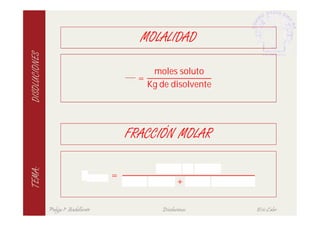
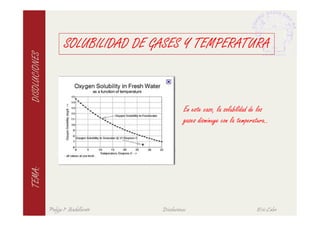
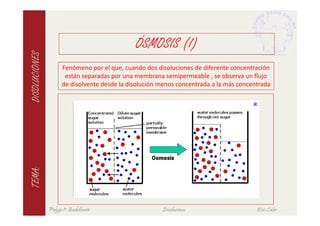
Este documento describe las características fundamentales de las disoluciones. Define una disolución como una mezcla homogénea de dos o más componentes donde el componente mayoritario es el disolvente y el menoritario es el soluto. Explica diferentes tipos de disoluciones según la fase de los componentes y métodos para expresar la concentración de una disolución. También cubre conceptos como solubilidad, propiedades coligativas y su variación con factores como la temperatura.