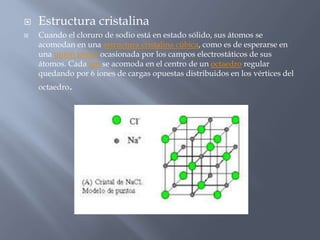
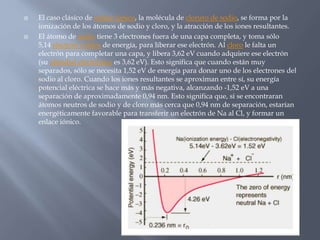
El documento describe las propiedades físicas y químicas de las sales, con un enfoque en el cloruro de sodio. Explica que las sales son compuestos iónicos formados por la unión de cationes y aniones, y que el cloruro de sodio tiene una estructura cristalina cúbica. También resume las propiedades físicas como su alto punto de fusión y baja compresibilidad, y las propiedades químicas como su capacidad de reaccionar con ácidos, bases y otros metales.