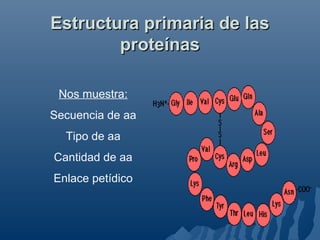
Este documento describe las proteínas, incluyendo su composición, funciones, clasificación y estructura. Las proteínas son polímeros formados por cadenas de aminoácidos unidos por enlaces peptídicos. Cumplen funciones como la catálisis enzimática, el transporte y el soporte estructural. Se clasifican según su forma, composición y origen. Su estructura primaria muestra la secuencia de aminoácidos, y las estructuras secundaria, terciaria y cuaternaria definen su plegamiento tridimensional