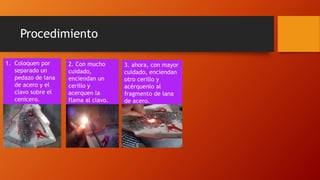
Este documento presenta información sobre la corrosión y el envejecimiento. Explica que la corrosión de los metales ocurre como resultado de procesos de oxidación cuando entran en contacto con oxígeno y humedad. También discute varias teorías sobre el envejecimiento biológico, incluida la teoría de los radicales libres, que vincula la oxidación con el envejecimiento prematuro debido al daño celular causado por los radicales libres. Además, analiza las aplicaciones del experimento de corrosión presentado,