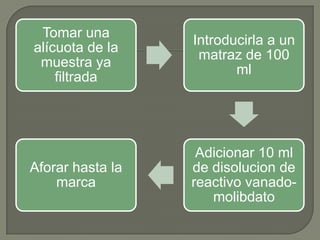
Este documento describe dos métodos para determinar fósforo total en aguas residuales, naturales y tratadas, de acuerdo a la norma NMX-AA-029-SCFI-2001. Explica el principio del método ácido vanadomolibdofosfórico, donde el vanadio y molibdato forman un complejo amarillo cuya intensidad de color depende de la concentración de fosfato. También detalla los pasos para realizar este método, incluyendo la preparación de disoluciones, medición de absorbancia y desarrollo de una