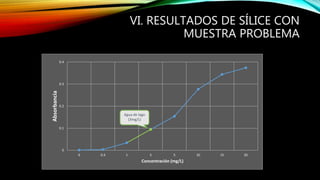
El resumen describe un proyecto de estudiantes de ingeniería química para determinar el contenido de sílice en una muestra de agua siguiendo la norma mexicana NMX-AA-75-1982. Los estudiantes prepararon soluciones requeridas y realizaron un análisis colorimétrico que arrojó una concentración de sílice de 3 mg/L en el agua de lago muestreada.