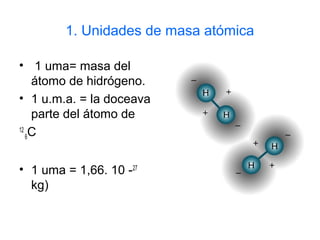
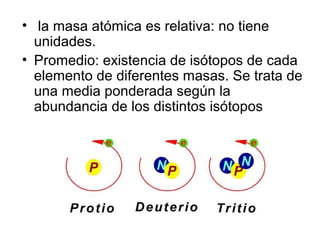
Este documento introduce las unidades de masa atómica y molecular, y la magnitud cantidad de sustancia medida en moles. Explica cómo las masas atómicas relativas permiten establecer una escala de masas y calcular masas moleculares. Finalmente, define el mol como la cantidad de sustancia que contiene el número de Avogadro de entidades elementales, permitiendo relacionar escalas micro y macroscópicas.