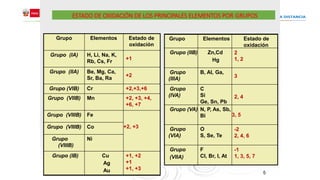
Este documento presenta información sobre nomenclatura inorgánica y estados de oxidación. Explica que la valencia es la capacidad de un átomo para enlazarse a otros átomos y no tiene signo, e introduce el concepto de número de oxidación o estado de oxidación como la carga aparente de un átomo. A continuación, detalla las reglas para determinar el estado de oxidación y proporciona tablas con los estados de oxidación más comunes para los elementos de cada grupo. Finalmente, define las principales funciones químicas inorgánicas como óx