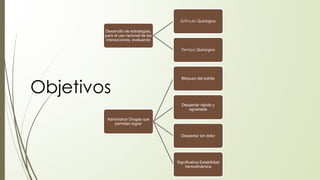
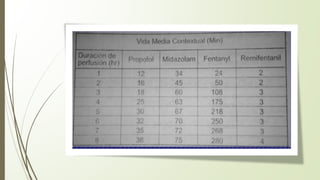
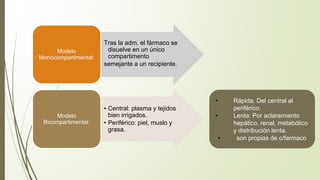
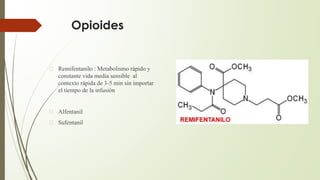
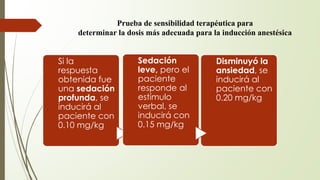
Este documento describe la técnica de anestesia general intravenosa total (TIVA). Explica conceptos como farmacocinética, modelos farmacocinéticos, sistemas de perfusión, interacciones farmacológicas y fármacos utilizados como propofol, opioides y dexmedetomidina. La TIVA permite un control preciso de la profundidad anestésica mediante la administración de drogas por vía intravenosa exclusivamente.