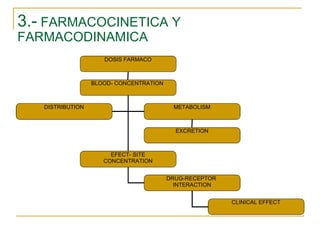
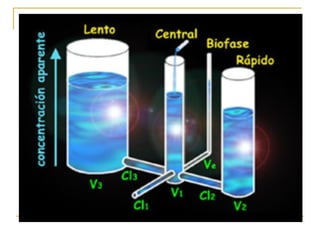
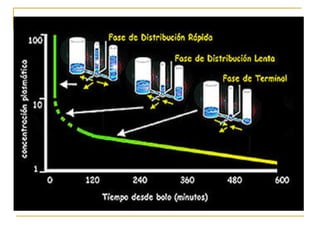
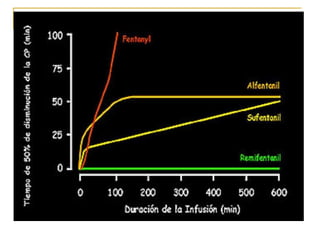
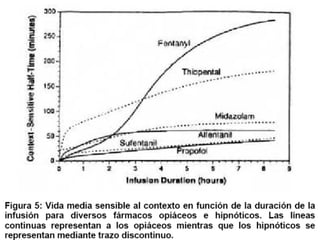
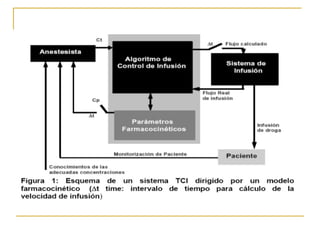
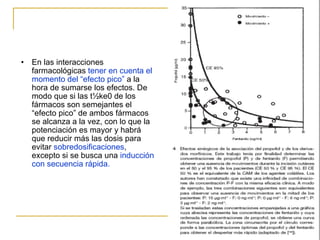
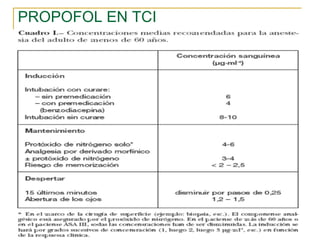
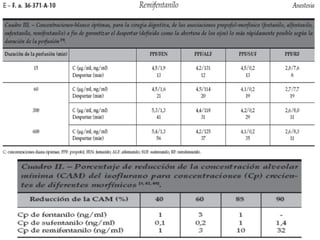
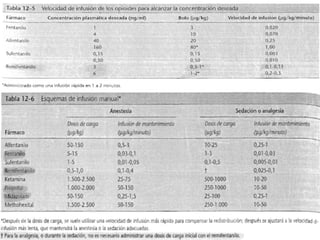
Este documento resume los principios generales de la anestesia intravenosa. Explica que la mayoría de los fármacos anestésicos siguen un modelo farmacocinético tricompartimental donde se distribuyen en tres compartimentos: central, periférico rápido y periférico lento. También describe conceptos como volumen de distribución, aclaramiento y tiempo de vida media, así como las ventajas e inconvenientes de la técnica de anestesia total intravenosa.