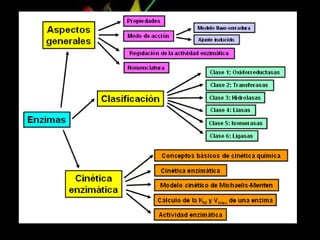
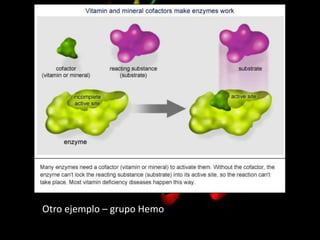
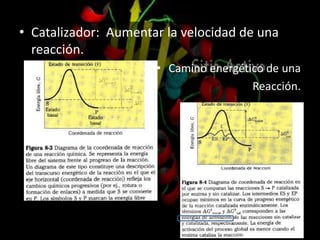
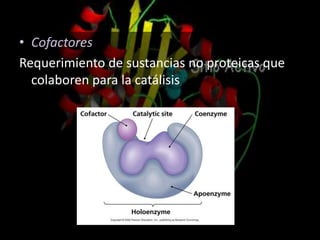
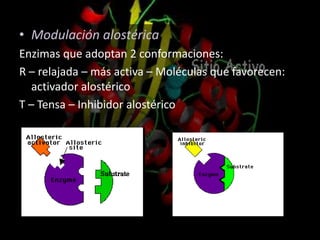
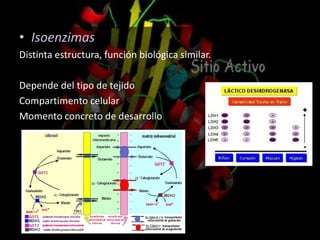
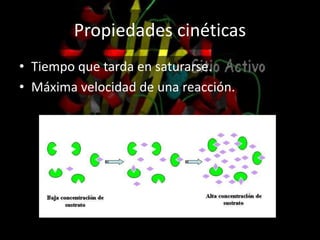
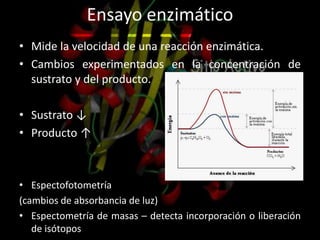
Las enzimas son proteínas que catalizan reacciones químicas de manera específica y eficiente. Pueden requerir cofactores como iones o grupos prostéticos para su actividad catalítica. Su estructura tridimensional determina su sitio activo y su especificidad por sustratos. La cinética enzimática estudia cómo la velocidad de reacción depende de factores como la concentración de sustrato, pH y temperatura.