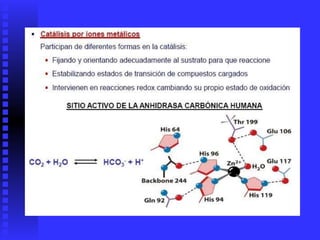
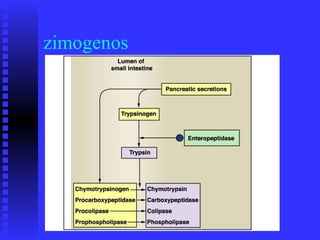
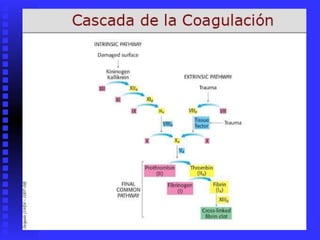
El documento habla sobre las enzimas. Brevemente:
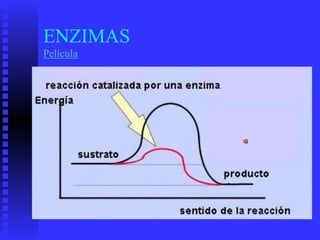
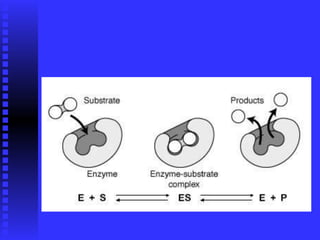
1. Las enzimas son proteínas que aceleran reacciones químicas específicas sin ser consumidas en el proceso.
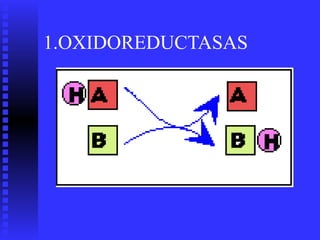
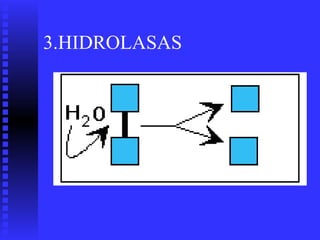
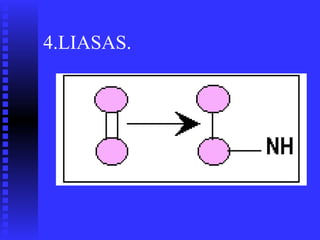
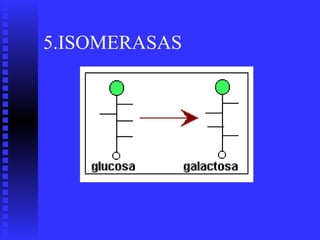
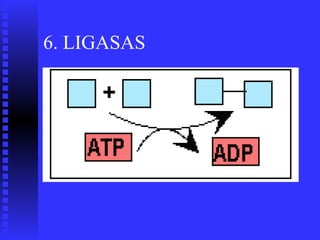
2. Existen diversos tipos de enzimas clasificadas según la reacción que catalizan como oxidorreductasas, transferasas e hidrolasas.
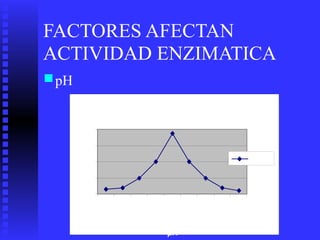
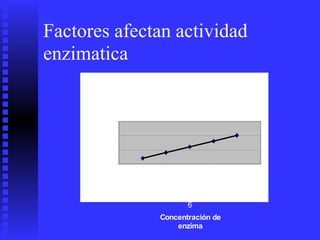
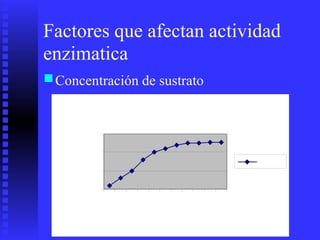
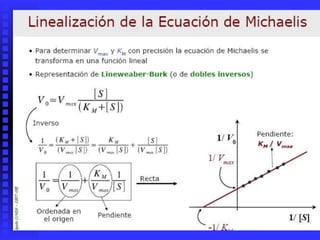
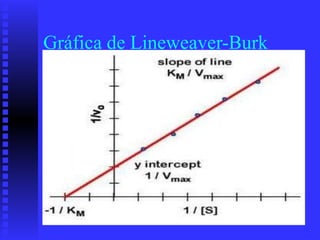
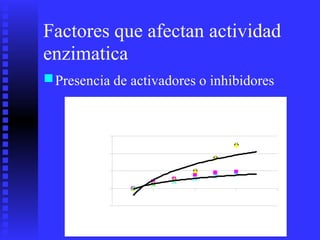
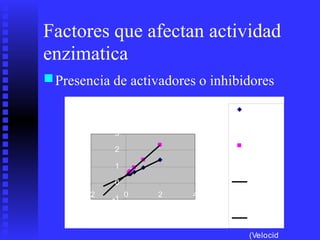
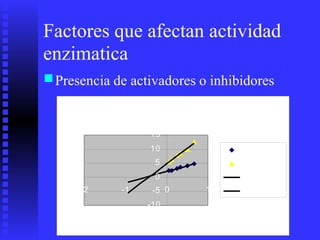
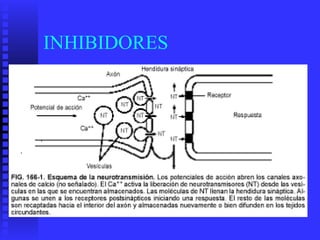
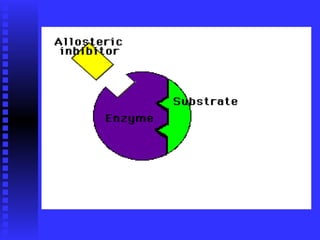
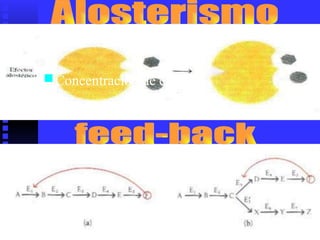
3. Múltiples factores afectan la actividad enzimática como la temperatura, pH, concentración de sustrato e inhibidores.
































![• Catálisis ácido-base
Reacciones por transformación intermediarios cargados inestables por
captación o cesión de
H•
A pH fisiológico [H•J y [OH·]
bajas
Baja
velocidad
Enzimas donantes o aceptares de [H•J ==---.....
Aumentan velocidad
--
·
Oen,en,Itdd ,.,_ 0.-,.ie."AI b�
fbt'ro
(prot.on a�lor)
AmlAotitld
!'ffid�
R-<X>O-
..
R-NUi
R-<lOOII
H
II
Glu. Nlp
......
.....
Cy•
ft..&.
.NH
R-�R-SH
·1-
'f'
R-
c-
s:
rn(c' 'ie 'c'N'II
1
1
111
•
"...
..
Tyr
u oR-011
·-0--
()1(
-o-](https://image.slidesharecdn.com/enzimasmipreset-161217221953/85/Enzimas-UAN-57-320.jpg)