Alquenos propiedades químicas
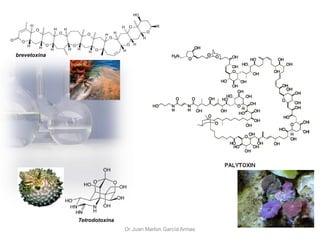
- 1. Dr Juan Marlon García Armas brevetoxina Tetrodotoxina
- 2. ALQUENOS
- 3. Dr Juan Marlon García Armas limoneno Retinol (Vitamina A)
- 4. Dr . Juan Marlon García Armas
- 5. Dr Juan Marlon García Armas USO INDUSTRIAL La elevada reactividad del doble enlace los hace importantes intermediarios de la síntesis de una gran variedad de compuestos orgánicos. Probablemente el alqueno de mayor uso industrial sea el ETILENO (eteno) que se utiliza entre otras cosas para obtener el plástico POLIETILENO, de gran uso en cañerías, envases, bolsas y aislantes eléctricos. También se utiliza para obtener alcohol etílico, etilen-glicol, cloruro de vinilo y estireno. El propileno (propeno) es materia prima del POLIPROPILENO, usado en la industria textil y para fabricar tubos y cuerdas. El ISOBUTILENO se utiliza para obtener tetra etilo de plomo, cuestionado aditivo de las naftas.
- 6. Dr Juan Marlon García Armas ISOMERÍA ISOMERÍA DE CONSTITUCIÓN ISOMERÍA DE ESQUELETO ISOMERÍA DE POSICIÓN ISOMERÍA FUNCIONAL ESTEREOISÓMEROS ISÓMEROS CONFORMACIONALES ISÓMEROS CONFIGURACIONALES ISÓMEROS GEOMÉTRICOS ISÓMEROS ÓPTICOS ENANTIOMEROS DIASTEROMEROS
- 7. Dr Juan Marlon García Armas ISOMERÏA GEOMETRICA Los alquenos y cicloalcanos pueden presentar isomería geométrica porque no existe rotación libre en el doble enlace o en un anillo. C C H H HH El C=C consta de un enlace s y un enlace que forma ángulo recto con el plano de los enlaces s a cada C. El enlace es más débil y reactivo que s. El enlace impide la rotación libre alrededor del C=C y en consecuencia un alqueno que tenga dos sustituyentes diferentes en cada C doblemente enlazado tiene isómeros geométricos.
- 8. Dr Juan Marlon García Armas ISOMERÍA DE ALQUENOS H H H CH2CH3 1-buteno H H CH3 CH3 2-metilbuteno H3C H H CH3 H H3C H CH3 cis-2-buteno trans-2-buteno Isomería geométrica La estereoisomería cis y trans en los alquenos no es posible cuando uno de los carbonos del doble enlace lleva dos sustituyentes idénticos. Por ejemplo: el 1-buteno y el 2 metilpropeno no son capaces de existir en forma estereoisómeras H H H CH2CH3 1-buteno H H CH3 CH3 2-metilbuteno Dos sustituyentes idénticos Dos sustituyentes idénticos Dos sustituyentes idénticos No hay estereoisómeros posibles !!
- 9. Dr Juan Marlon García Armas C C C C H3C H CH3 H H H3C CH3 H cis-2-buteno (p.e. 3,7 o C) trans-2-buteno (p.e. 0,9 o C) 1 2 El cis y el trans-2-buteno difieren unicamente en las direcciones que toman los grupos metilo en sus extremos. Poseen propiedades físicas diferentes (punto de fusión, punto de ebullición, etc.), y solo son interconvertibles por medio de una reacción química H3C H H H H CH3 H3C H H H CH3 H cis -1,2-dimetilciclopropano (p.e. 37 o C) trans -1,2-dimetilciclopropano (p.e. 28 o C) En compuestos cíclicos tales como el ciclopropano, evidentemente no es posible la libre rotación en torno a los enlaces s que forman el anillo, mientras permanezca intacto.
- 10. Dr Juan Marlon García Armas C C H Cl Cl H C C H Cl H Cl C C H HOOC COOH H C C H HOOC H COOH Nombre Estructura Pto eb. oC Pto. fus oC cis-1,2-dicloroeteno 60,3 -80,5 trans-1,2- dicloroeteno 47,5 -50 Ácido maleico - 130 Ácido fumárico - 28,7 Propiedades De Algunos Isómeros Geométricos
- 11. Dr Juan Marlon García Armas NOMENCLATURA DE ALQUENOS ESTEREISÓMEROS POR EL SISTEMA DE NOTACIÓN E-Z H3C(H2C)6H2C H H CH2(CH2)6COOH H C6H5 H CH Ácido Oleico Cinamaldehído O (olor característico de la canela) Cl H F Br Cl H Br F inferior superior superior inferior superior inferior superior inferior Configuración Z Configuración E Para especificar la estereoquímica del doble enlace se basa en al ordenación de los sustituyentes de los carbonos del doble enlace basados en el número atómico. Cuando los átomos con mayor número atómico están del mismo lado del doble enlace se le denomina configuración Z. Cuando los átomos de números atómicos más altos están de lados opuestos del doble enlace, decimos que la configuración es E
- 12. Dr Juan Marlon García Armas PROPIEDADES FÍSICAS DE LOS ALQUENOS Comparación de longitud y ángulo de enlace entre el propano y el propeno Energías de enlace entre el etano y el eteno
- 13. Dr Juan Marlon García Armas Costo Energético de la rotación de un doble enlace La rotación de un doble enlace está impedida porque implica la disrupción del solapamiento lateral de los orbitales p que forman la nube del doble enlace. Esto tiene un coste energético mucho más alto que la rotación de un enlace sencillo Trans Cis
- 14. Dr Juan Marlon García Armas Los alquenos de bajo peso molecular hasta C4H8 son gases a T° y a Pr ambiente. Nombre del Compuesto Fórmula estructural Pto. de Ebullición, °C Pto. de Fusión, °C Momento dipolar m, D Butano CH3CH2CH2CH3 0 -138 0 1-buteno CH2=CHCH2CH3 -6 -185 0.3 Cis-2-buteno 4 -139 0.3 Trans -2-buteno 1 -105 0 2-metilpropeno (CH3)2C=CH2 -7 0.5 CH3H3C H H HH3C H CH3 Los puntos de ebullición y fusión de los alquenos son parecidos a los alcanos correspondientes. La estereoquímica E/Z de los alquenos afecta a sus constantes, sobre todo los puntos de fusión, que dependen de un mejor o peor empaquetamiento cristalino.
- 15. Dr Juan Marlon García Armas H H H H H Cl H H H H H3C H H Cl H3C H m= 0 D m= 1.4 D m= 0.3 D m= 1.7 D Los enlaces C(sp3)-C(sp2) tienen un ligero momento dipolar porque los carbonos oléfinicos son ligeramente más electronegativos que los alifáticos. Esto se debe al mayor caracter s de la hibridación sp2 de los alquenos. Pero la polaridad de la molécula depende de la estereoquímica E/Z de la olefina Polaridad del doble enlace Cis Trans
- 16. Dr Juan Marlon García Armas Los alquenos no se pueden catalogar como ácidos pero sus propiedades ácidas son un millón de veces mayores que las de los alcanos Acidez relativa de los alquenos El mayor desplazamiento del equilibrio de desprotonación del etileno, en comparación con el etano, nos demuestra que el carbanión del etileno es ligeramente más estable que el del etano. Esto tiene que deberse a la mayor electronegatividad de un carbono sp2, que estabiliza la carga negativa
- 17. Dr Juan Marlon García Armas Preparación de Alquenos 1. La eliminación es el método más general de preparación de un alqueno 2. También pueden obtenerse por REDUCCIÓN parcial de alquinos
- 18. C CR R + H2 Cat RR ADICIÒN DE H2 A ALQUINOS R C C R + Na / NH3 R R
- 19. Dr Juan Marlon García Armas PROPIEDADES QUIMICAS DE LOS ALQUENOS
- 20. Dr Juan Marlon García Armas ALQUENOS Mas reactivo que alcanos Reacciones de Adición Mediante reacciones de Eliminación se forman Alquenos Experimentan reacciones tipo: Reacciones de Oxidación
- 21. Dr Juan Marlon García Armas Propiedades químicas de los Alquenos El enlace doble (C=C) es muy reactivo. Debido a la ruptura del enlace (que forma parte del doble enlace), los alquenos presentan reacciones de adición. En estas reacciones las partes de una molécula (reactivo) se unen a los extremos opuestos de un doble enlace, el cual se convierte a un enlace sencillo. C C + X Y C X C Y a. REACCIONES DE ADICIÓN DE LOS ALQUENOS
- 22. Dr Juan Marlon García Armas Hidrogenación Catalítica C C + H H C H C H alqueno alcano catalizador + H2 Pt + H2 Pd
- 23. Dr Juan Marlon García Armas La hidrogenación de un alqueno da lugar al alcano correspondiente, por adición de hidrógeno al doble enlace. La energía desprendida depende de la estructura del alqueno y su medida nos da la idea de su estabilidad relativa. De los tres posibles butenos, el isómero trans es el que desprende menos calor de hidrogenación y, por tanto, debe ser el más estable. El 1-buteno es el menos estable porque es al que le corresponde la reacción más exotérmica. En general se observa que la estabilidad de un alqueno aumenta con la sustitución: Tetrasustituído > Trisustituído > Disustituído > Mononosustituído > Etileno Los isómeros trans son más estables que los correspondientes cis, porque aquéllos tienen menos interacciones estéricas desestabilizantes que éstos.
- 24. Hidrogenación catalítica de alquenos (cont.) C=C + H2 C-C El hidrógeno se escinde en la superficie del metal, formándose dos átomos de hidrógeno electrófilos y muy reactivos. La nube del doble enlace es así atacada fácilmente por éstos, obteniéndose el alcano correspondiente Cat
- 26. Reacciones de Adición en los Alquenos Adición Polar
- 28. Dr Juan Marlon García Armas C C + X X C X C X alqueno dihaluro alquílico + Cl2 + Br2 Cl Cl Br Br REACCIONES DE ADICIÓN POLAR: 1. ADICIÒN DE HALOGENOS
- 29. REACCIONES DE ADICIÓN POLAR: 1. ADICIÒN DE HALOGENOS Br Br Br Br E Nu d+ d-
- 30. 1. ADICIÒN DE HALOGENOS. El Mecanismo
- 31. Dr Juan Marlon García Armas C C H R´ R ´´R + H OH R C R´´ OH C R´ H H alqueno alcohol agua H+ + H2O H2SO4 OH + H2O H2SO4 OH Orientación Markovnikov REACCIONES DE ADICIÓN POLAR: 2. ADICIÒN DE AGUA
- 32. REACCIONES DE ADICIÓN POLAR: 2. ADICIÒN DE AGUA
- 33. Dr Juan Marlon García Armas C C H R´ R ´´R + H G R C R´´ G C R´ H H alqueno haluro alquílico Regla de Markonikov “Cuando un reactivo asimétrico del tipo H-G se adiciona a un alqueno asimétrico, el carbono con el mayor número de hidrógenos obtiene uno más” REACCIONES DE ADICIÓN POLAR: 3. ADICIÒN DE ACIDOS (I)
- 34. REACCIONES DE ADICIÓN POLAR: 3. ADICIÒN DE ACIDOS (I)
- 35. REACCIONES DE ADICIÓN POLAR: 3. ADICIÒN DE ACIDOS (II)
- 36. REACCIONES DE ADICIÓN POLAR. MECANISMOS Ataque Electrofìlico Ataque Nucleofílico
- 37. REGLA DE MARKOVNIKOV. Adición de Reactivos Asimétricos en los Alquenos Asimètricos
- 39. REGLA DE MARKOVNIKOV. Adición de Reactivos Asimétricos en los Alquenos Asimètricos Cuando un reactivo asimétrico se adiciona a un alqueno asimétrico , la parte electropositiva del reactivo se une al carbono del doble enlace que tiene el mayor número de hidrógenos
- 40. REGLA DE MARKOVNIKOV. Mecanismo de Reacción. Ejemplo La reacción transcurre a través del catión intermedio mas estable
- 41. REGLA DE MARKOVNIKOV. Estabilidad de los Carbocationes
- 42. Cualquiera de los cuatro haluros de hidrógeno (HI, HBr, HCl ó HF) da la reacción que es regioselectiva: El producto formado depende de la estabilidad relativa de los carbocationes intermedios. La protonación inicial de la olefina se produce de forma que se obtenga el carbocatión menos inestable.
- 43. REGLA DE MARKOVNIKOV. Enunciado Final La adiciòn electrofílica de un reactivo asimétrico a un alqueno asimétrico transcurre de manera en que interviene el carbocatión más estable
- 44. Reacciones Anti-Markovnikov La regioquímica de la reacción cambia. El mecanismo debe ser, por tanto, diferente. El mecanismo de esta reacción no transcurre mediante carbocationes sino a través de radicales libres.
- 45. Reacciones Anti-Markovnikov: Mecanismo RO-OR 2RO . 2RO + 2HBr 2ROH + Br. . CH3CH2CH=CH2 + Br CH3CH2CH-CH2Br. . CH3CH2CH-CH2Br + HBr CH3CH2CH2-CH2Br + Br . .
- 46. LA HIDROBORACIÓN: ADICIÒN DE DIBORANO Adición del B2H6 al doble o triple enlace. Transcurre mediante una reacción concertada: La ruptura y formación de enlace transcurre en un solo paso. Obtenciòn de alquilboranos y alquenilboranos
- 47. Mecanismo
- 48. Dr Juan Marlon García Armas Propiedades químicas de los Alquenos B. REACCIONES DE OXIDACIÓN DE LOS ALQUENOS Oxidación de Alquenos C C H R´ R ´´R + KMnO4 alqueno H+ R O ´´R O R´ OH + cetona ácido carboxílico La solución caliente de KMnO4 oxida vigorosamente a los alquenos llegando a fragmentar la molécula y formar cetonas y ácidos carboxílicos C C H R´ R ´´R + KMnO4 alqueno OH- glicol R C R´´ OH C R´ OH H
- 49. B. OXIDACIÓN DE ALQUENOS B.1. OXIDACIÓN CON KMnO4 B.1.1. Obtención de Glicoles. Cuantificación e identificación de insaturaciones
- 50. El cambio de color pone de manifiesto la presencia de un doble enlace
- 51. B.1.2. Obtención de Carbonilos
- 52. B.2. OXIDACIÓN con O3. Ozonolisis Reacción de ruptura de doble enlace y formación en su lugar de dos grupos carbonilo en los átomos de carbono que sustentaban El mecanismo
- 54. Localizaciòn de posición de insaturación por reactivo de oxidación
- 55. B.3. OXIDACIÓN CON O2
- 56. Dr Juan Marlon García Armas
- 57. Dr Juan Marlon García Armas Preparación de Alquenos 1. La ELIMINACIÓN es el método más general de preparación de un alqueno 2. También pueden obtenerse por reducción parcial de alquinos
- 58. La proporción de eliminación aumenta utilizando bases fuertes y voluminosas. El volumen estérico de la base influye en la regioquímica de la eliminación. Base/disolvente % % CH3CH2O-/CH3CH2OH 70 30 (CH3)3CO-/(CH3)3COH 23 77 Eliminación tipo: Saytzev Hofmann La base más voluminosa ataca preferentemente a hidrógenos metílicos, que son los más externos y los menos impedidos estéricamente. Esto da lugar a una mayor proporción de la olefina menos estable termodinámicamente. La eliminación mediante un mecanismo E2 necesita que el grupo saliente y un hidrógeno en b estén en disposición anti
- 59. REACCIONES DE ELIMINACIÓN EN LA FORMACIÓN DE ALQUENOS
- 60. REACCIÓN DE LOS HALOGENUROS DE ALQUILO Reacción en la que se elimina el halógeno y el hidrógeno del carbono adyacente (deshidrohalogenación), desaparecen dos enlaces s y en su lugar se forma un enlace
- 61. Reacción de halogenuros de alquilo. Diagrama Energético
- 62. Reacción de halogenuros de alquilo. Clasificación
- 63. Reacción en un único paso: el nucleófilo actúa como base y arranca un protón del carbono adyacente al halógeno (grupo saliente). Simultáneamente salta el grupo saliente y se forma el doble enlace, orden bimolecular Reacción de Eliminación E2 La eliminación bimolecular E2 transcurre sin intermedios y consta de un único ET, en el que la base abstrae el protón, el grupo saliente se va y los dos carbonos implicados se rehibridan desde la sp3 a la sp2.
- 64. La eliminación mediante un mecanismo E2 necesita que el grupo saliente y un hidrógeno en b estén en disposición anti.
- 65. Reacción dos pasos: primero se suelta el nucleófilo del sustrato (el halógeno), formándose el catión y a continuación se produce la salida del protón y la formación del doble enlace, orden unimolecular Reacciones de Eliminación E1
- 66. El carbocatión producido por la salida del halógeno o en general, del grupo saliente, puede tener una evolución alternativa: El nucleófilo, actuando como base, puede extraer un protón del carbono adyacente al carbocatión, dando lugar a una olefina
- 67. En el caso de la metanolisis del cloruro de terc- butilo es el metanol el que actúa como base, se lleva el protón y da lugar a isobutileno.
- 68. Reacciones de Eliminación E1 ¿Dónde se produce?
- 69. Base/disolvente % % 70 30 27 73 La base más voluminosa ataca preferentemente a hidrógenos metílicos, que son los más externos y los menos impedidos estéricamente. Esto da lugar a una mayor proporción de la olefina menos estable termodinámicamente
- 70. Dr Juan Marlon García Armas