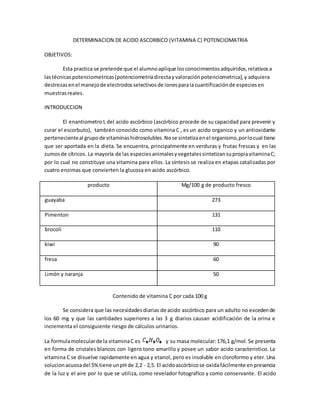
Este documento describe un procedimiento para cuantificar la concentración de ácido ascórbico (vitamina C) en una muestra a través de la potenciometría. Explica cuatro métodos comunes para la titulación del ácido ascórbico con agentes oxidantes como el 2,6-diclorofenol-indofenol, el yodo, el yodato/yodo y la N-bromosuccinamida. También describe los pasos para realizar una determinación potenciométrica directa, incluyendo la preparación de curvas de calibración