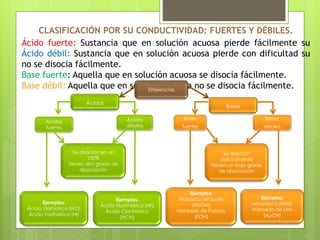
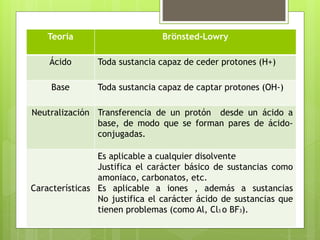
La teoría de Brönsted-Lowry establece que los ácidos son sustancias que pueden ceder protones y las bases son sustancias que pueden aceptar protones. Define una reacción ácido-base como la transferencia de un protón de un ácido a una base, formando así un par de ácido-base conjugados. Además, explica el comportamiento anfótero del agua al actuar como ácido o base dependiendo de la sustancia con la que reaccione.






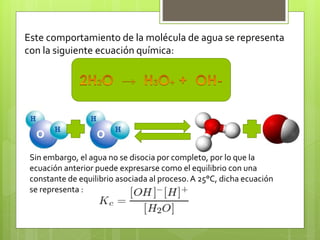
![A la constante de equilibrio Kw se le conoce como producto iónico del
agua debido a que corresponde al producto de las concentraciones
concentraciones molares de los iones H+ y OH- a una temperatura
especifica. De manera experimental, se ha determinado que en el agua
pura a 25°C, el valor de Kw es de 1x10 M , donde M=______
2-14
Mol
l
2
2
Dado que al equilibrio la concentración de los iones es la misma ,
entonces:
Pero el equilibrio [H+]= [OH-], por lo tanto:
Y dado que [H+]= [OH-0] al
equilibrio, entonces:
Si esa igualdad se cumple se dice que la disolución es neutra. En tanto si la
disolución es acida, existe una mayor concentración de iones H+, por lo que
[H+]> [OH-] si, por lo contrario, la disolución es básica, existe un exceso de iones
de hidroxilo, por lo que [H+] < [OH-].](https://image.slidesharecdn.com/teoradebrnsted-lowry-140526212807-phpapp01/85/Teoria-de-bronsted-lowry-y-par-conjugado-10-320.jpg)