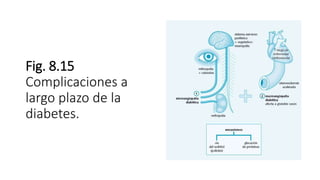
1. El documento describe la homeostasis de la glucosa y su regulación por la insulina y el glucagón.
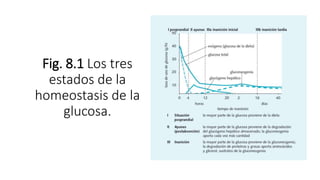
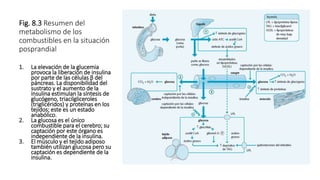
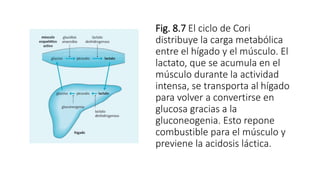
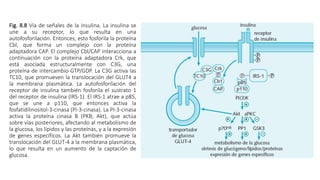
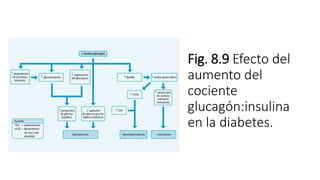
2. Explica cómo la insulina estimula la captación y almacenamiento de glucosa en situaciones posprandiales, mientras que el glucagón favorece la liberación de glucosa en ayunas.
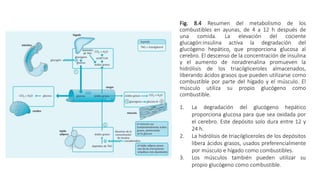
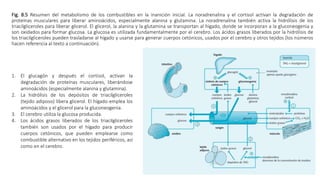
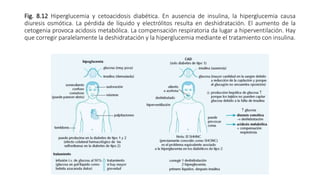
3. También analiza los mecanismos de producción de glucosa en situaciones de inanición, a través de la gluconeogénesis en el hígado utilizando aminoácidos y glicerol.