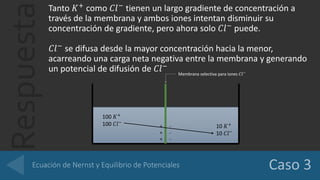
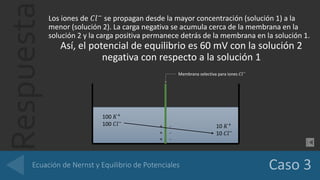
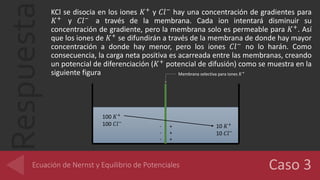
El documento analiza el potencial de diferenciación a través de membranas selectivas para iones K+, Cl-, y Ca2+, utilizando la ecuación de Nernst para calcular los potenciales de equilibrio. Se detalla cómo la acumulación de cargas en las membranas genera un potencial que compensa el gradiente de concentración, logrando equilibrio electroquímico sin modificar las concentraciones de los iones en las soluciones. Además, se evalúa la conductancia de una fibra nerviosa, determinando que Cl- es el ion con mayor permeabilidad, seguido por K+ y Na+.




![Respuesta La ecuación de Nernst se utiliza para calcular la magnitud
del potencial de diferenciación generado por la difusión
de un solo ion permanente (en este caso, 𝐾+
). Así, la
ecuación de Nernst se usa para calcular el potencial de
equilibrio de un ion por una diferencia de concentración a
través de la membrana, asumiendo que la membrana es
permeable solo a ese ion.
𝐸 = −
2.3 𝑅𝑇
𝑧 𝐹
𝑙𝑜𝑔10
[𝐶1]
[𝐶2]](https://image.slidesharecdn.com/ecuacindenernst-160221020429/85/Ecuacion-de-nernst-6-320.jpg)
![Respuesta 𝐸 = −
2.3 𝑅𝑇
𝑧 𝐹
𝑙𝑜𝑔10
[𝐶1]
[𝐶2]
Donde:
E = potencial de equilibrio (mV)
2.3 RT/F = constantes (60 mV a 37°C)
z = carga del ion (incluyendo el signo)
𝐶1 = concentración del ion en una solución (mmol/L)
𝐶2 = concentración del ion en la otra solución (mmol/L)](https://image.slidesharecdn.com/ecuacindenernst-160221020429/85/Ecuacion-de-nernst-7-320.jpg)