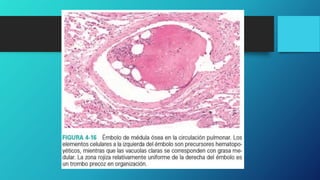
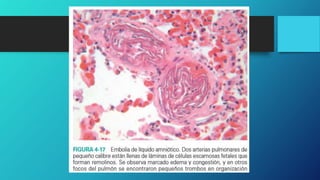
El documento describe diferentes tipos de embolia, incluyendo émbolos sólidos, líquidos y gaseosos. Explica que un émbolo es una masa que se libera en los vasos sanguíneos y es transportada a otras áreas, pudiendo obstruir el flujo sanguíneo. Describe las consecuencias como infartos e insuficiencia de órganos si el flujo sanguíneo es bloqueado. También explica las diferentes etapas del shock, una condición potencialmente mortal que puede ocurrir si no se corrige la