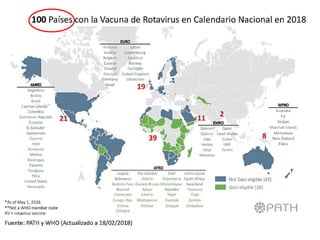
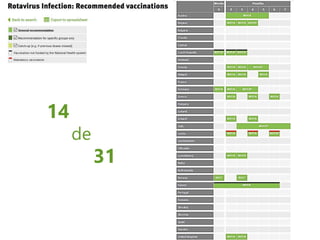
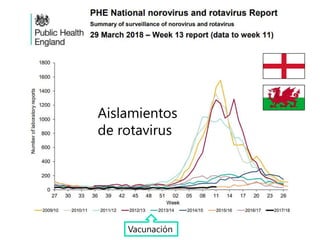
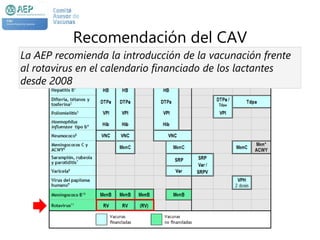
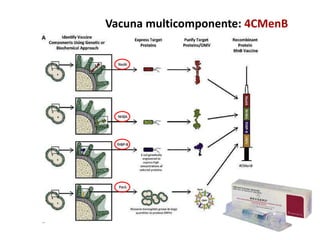
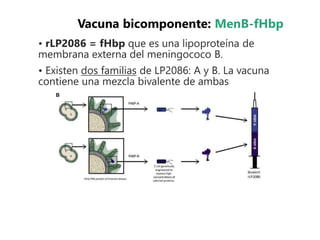
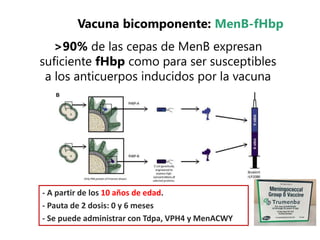
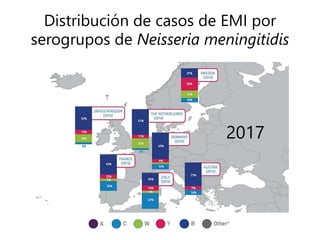
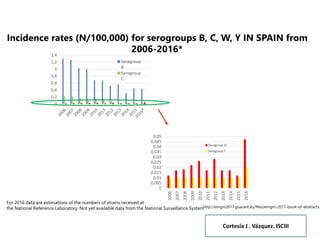
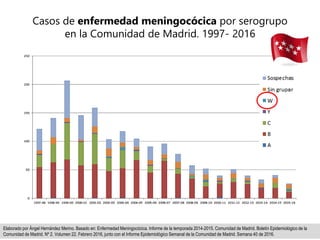
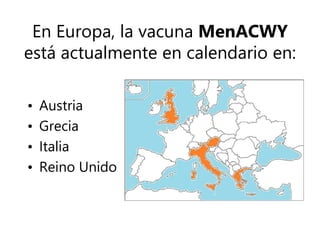
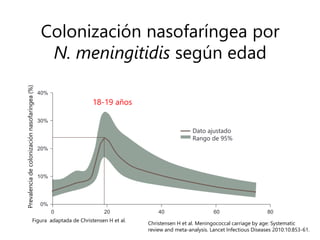
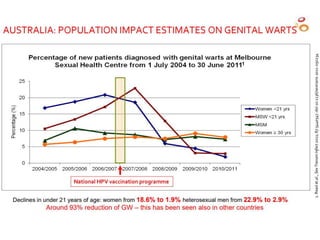
El documento resume las recomendaciones sobre varias vacunas en España. Brevemente discute los beneficios de la vacuna contra el rotavirus en reducir las hospitalizaciones por gastroenteritis aguda, y las recomendaciones del Comité Asesor de Vacunas para su uso. También cubre las vacunas contra el meningococo B y C, incluyendo datos sobre su efectividad y la recomendación de su uso sistemático en lactantes. Finalmente, analiza las vacunas contra meningococo ACWY y VPH, con información sobre su composición, edades recomendadas y