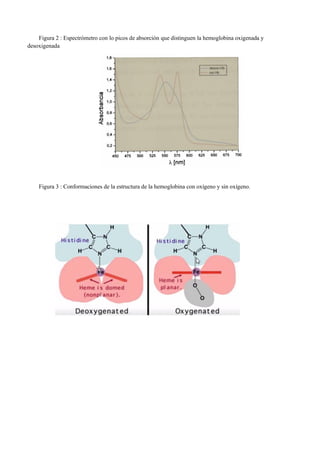
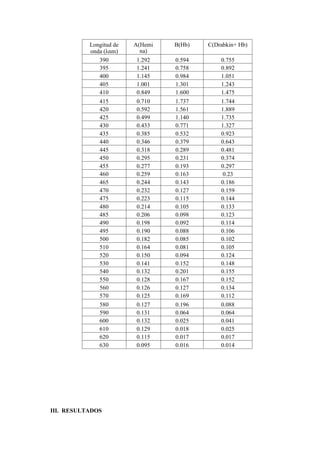
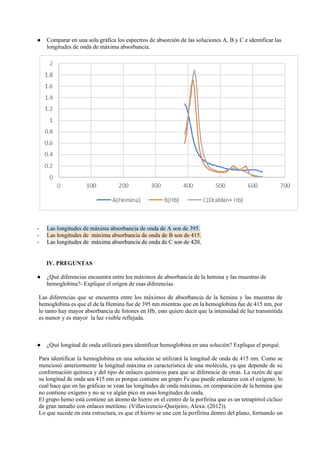
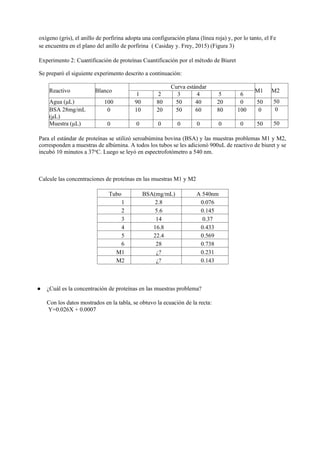
Este documento describe experimentos sobre espectrofotometría y cuantificación de proteínas. Se realizó un espectro de absorción de la hemoglobina, hemina y hemoglobina con reactivo de Drabkin, observando picos máximos a 415 nm, 395 nm y 420 nm respectivamente. También se explican las diferencias estructurales entre hemoglobina oxigenada y desoxigenada que causan sus diferentes espectros. Finalmente, se cuantificaron proteínas mediante el método de Biuret.







![10.Lewis S, Bain BJ, Bates L. Dacie y Lewis Hematología práctica. 10th edición. Elsevier. España. 2008
11. METODOS PARA LA CUANTIFICACION DE PROTEINAS.pdf [Internet]. [citado 15 de abril de
2021]. Disponible en: https://www.uco.es/dptos/bioquimica-biol-
mol/pdfs/27%20METODOS%20PARA%20LA%20CUANTIFICACION%20DE%20PROTEINA
S.pdf
12. Roger L. Bertholf, PhD, DABCC, FACB, Proteins and Albumin, Laboratory Medicine, Volume 45,
Issue 1, February 2014, Pages e25–e41, https://doi.org/10.1309/LMKRNRGW5J03APZQ
13. Sánchez-Lara, E. La Hemoglobina: un ejemplo de química bioinorgánica.Recuperado en 27 de
marzo de 2022, de https://icuap.buap.mx/docs/010.pdf
14.Sapan, C. V., Lundblad, R. L., & Price, N. C. (1999). Colorimetric protein assay techniques.
Biotechnology and applied Biochemistry, 29(2), 99-108.
https://iubmb.onlinelibrary.wiley.com/doi/abs/10.1111/j.1470-8744.1999.tb00538.x
15. Villavicencio-Queijeiro, Alexa. (2012). La mitocondria como fábrica de cofactores: biosíntesis de
grupo hemo, centros Fe-S y nucleótidos de flavina (FMN/FAD). TIP. Revista especializada en
ciencias químico-biológicas, 15(2), 116-132. Recuperado en 26 de marzo de 2022, de
http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-
888X2012000200005&lng=es&tlng=es.
16.(S/f). Wordpress.com. Recuperado el 30 de marzo de 2022, de
https://bioquimica11usac.files.wordpress.com/2012/10/lab_8_manual_2017.pdf
VII. ANEXOS:
Figura 1: Espectrofotómetro](https://image.slidesharecdn.com/informe1bioqumica-220411204055/85/INFORME-1-BIOQUIMICA-pdf-11-320.jpg)