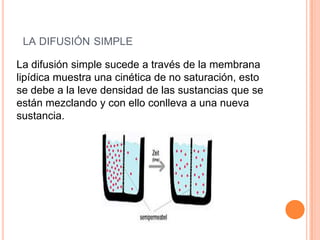
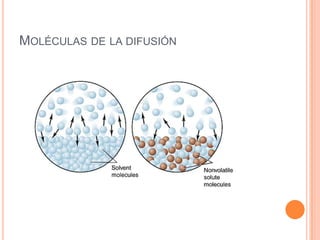
La difusión es un fenómeno en el que dos sustancias se mezclan espontáneamente sin reacciones químicas. Existen distintos métodos para separar los componentes de disoluciones y compuestos, como la evaporación, destilación y electrólisis. Además, se describen conceptos relacionados como la solubilidad, punto de fusión y ebullición, y la densidad, destacando la diferencia entre el agua y el aceite en términos de densidad y atracción intermolecular.