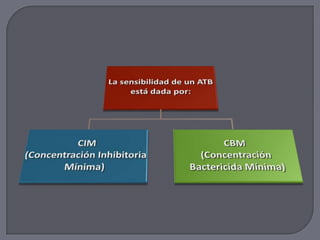
Este documento proporciona información sobre el antibiograma, que determina la sensibilidad de un microorganismo a diferentes antibióticos mediante pruebas in vitro. Describe los métodos de dilución y difusión para realizar el antibiograma, incluidos la preparación del inóculo bacteriano, la inoculación de placas de agar, la aplicación de discos de antibióticos y la medición de zonas de inhibición. El objetivo es determinar la concentración inhibitoria mínima y la concentración bactericida mínima de diferentes antibióticos contra la