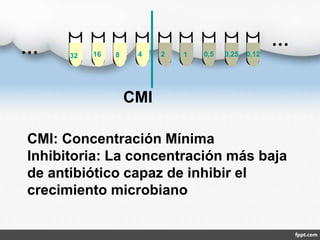
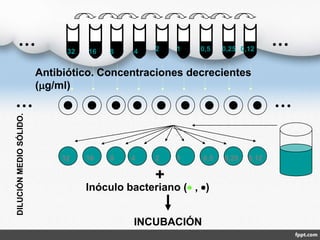
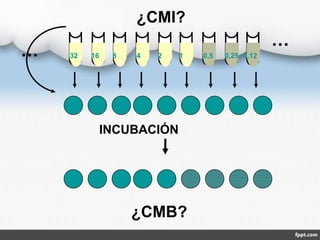
El documento describe los métodos de antibiograma, que determinan la susceptibilidad de microorganismos a agentes antimicrobianos. Los antibiogramas miden la sensibilidad de cepas bacterianas a antibióticos específicos, con objetivos terapéuticos y epidemiológicos. Existen métodos como la dilución en medio líquido o sólido y la difusión en disco, que permiten medir la concentración mínima inhibitoria o bactericida de un antibiótico.