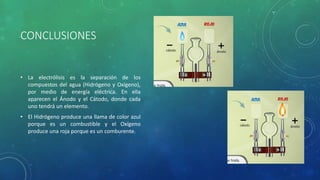
Este documento describe un experimento para separar las moléculas de agua (H2O) en sus elementos constituyentes (hidrógeno y oxígeno) mediante electrólisis. El objetivo es usar un aparato de Hoffman y una fuente eléctrica para dividir la molécula de agua. El procedimiento involucra llenar el aparato con una solución de hidróxido de sodio y aplicar una corriente eléctrica de 9 voltios durante 8 minutos. Como resultado, se observa que el hidrógeno aparece en el cátodo y