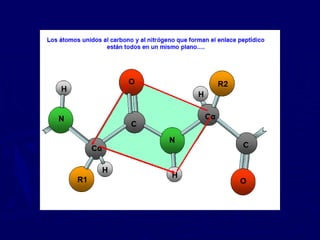
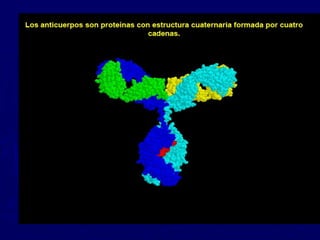
Las proteínas están compuestas de cadenas de aminoácidos cuya secuencia determina su estructura y función. Existen cuatro niveles de estructura proteica: primaria dada por la secuencia de aminoácidos, secundaria conformada por alfa hélices y hojas plegadas, terciaria definida por la configuración tridimensional de las cadenas laterales, y cuaternaria resultante de la unión de múltiples cadenas polipeptídicas. Las proteínas globulares solubles cumplen funciones dinámicas mientras que