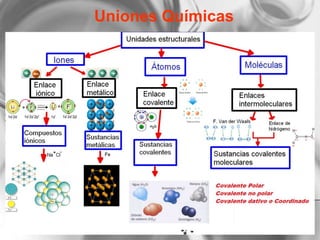
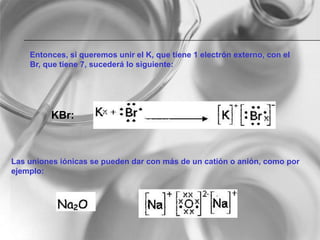
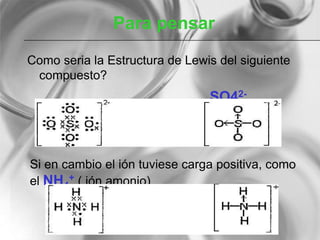
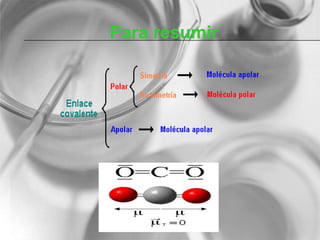
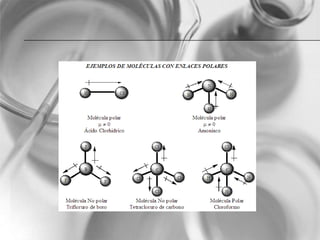
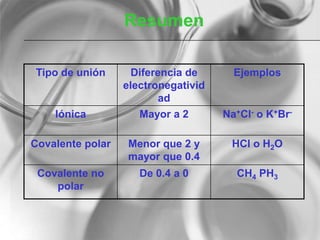
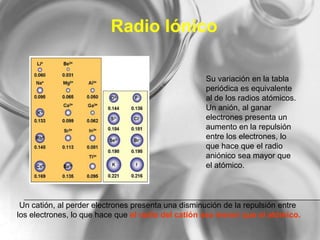
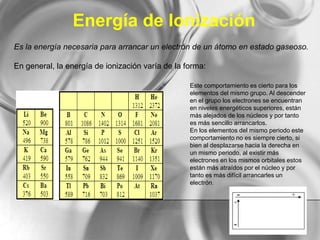
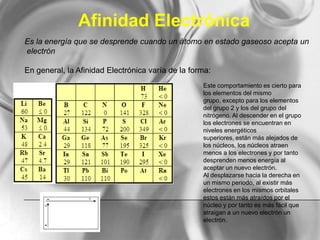
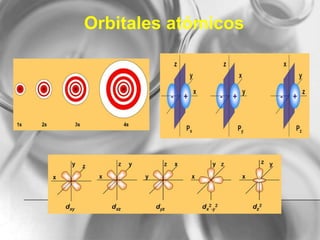
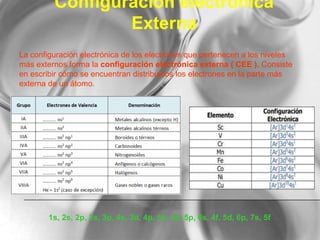
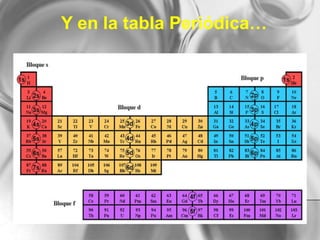
El documento resume conceptos básicos de la configuración electrónica, incluyendo: 1) cómo varían el radio atómico, iónico, energía de ionización y afinidad electrónica a través de la tabla periódica; 2) los números cuánticos y su relación con los orbitales atómicos; y 3) el orden de llenado de orbitales según la regla de Hund y excepciones a esta regla. También explica la configuración electrónica externa y su importancia para entender las propiedades químicas de los







![Ejemplos:
He(2 electrones):
n = 1, l = 0, ml = 0 ms = +1/2, -
1/2
1s2
Ne(10 electrones):
n = 1, l = 0, ml = 0 ms = +1/2, -
1/2
1s2
n = 2, l = 0, ml = 0 ms = +1/2, -
1/2
2s2
n = 2, l = 1, ml = -1 ms = +1/2, -
1/2
2px
n = 2, l = 1, ml = 0 ms = +1/2, -
1/2
2py
n = 2, l = 1, ml = 1 ms = +1/2, -
1/2
2pz
La configuración electrónica será: 1s22s22p6 o bien [He]2s22p6
Repasando…](https://image.slidesharecdn.com/qbiol3-140407174336-phpapp02/85/Qbiol3-13-320.jpg)














![6- Completar
el
siguiente
cuadro:
Símbol
o
Z A p e- N Configuració
n
Electróni
ca
C 6 6
Fe 56 26
S 32 16
K+ 20 1s22s22p63s2
3p6
O-2 10 8
Mn 25 55
Ag 108 [Kr] 5s2 4d9
Rb+ 85 37
Zn 30 357-El elemento M forma un ion estable isoelectrónico con el anión X2-.
El isótopo 40M tiene 21 neutrones en su núcleo.
a) Indicar símbolo y carga de dicho ion de M
b) Indicar la C.E.E. del elemento X](https://image.slidesharecdn.com/qbiol3-140407174336-phpapp02/85/Qbiol3-30-320.jpg)