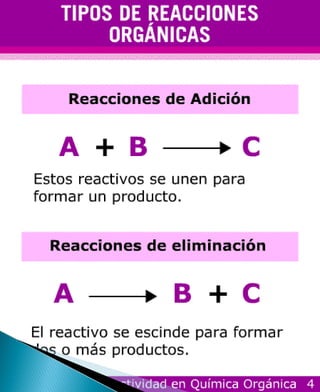
Este documento describe diferentes tipos de reacciones orgánicas como sustitución, adición, eliminación y redox. Explica cómo la polaridad de los grupos funcionales determina la reactividad química de los compuestos orgánicos. Resume las propiedades físicas y químicas de alcanos, alquenos y alquinos, incluyendo sus puntos de ebullición, densidad y solubilidad.