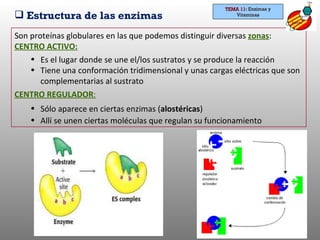
El documento habla sobre enzimas y vitaminas. Explica que las enzimas son proteínas que actúan como catalizadores de reacciones bioquímicas de forma específica. Describe la reacción enzimática y factores que afectan la actividad enzimática como pH, temperatura e inhibidores. También cubre la clasificación de enzimas y tipos de inhibición. Finalmente, define las vitaminas como biomoléculas esenciales que no pueden ser sintetizadas y deben obtenerse de la dieta, y explica tipos de












![Inhibición de la actividad enzimática IRREVERSIBLE: también llamados venenos El inhibidor se une fuertemente a E , destruyendo , modificando o bloqueando su centro activo. Si ↓ [Inhibidor] no varía el grado de inhibición. Ejemplos: La penicilina se une al centro activo de una enzima encargada de sintetizar la PC de bacterias la enzima se inhibe la PC no se forma y la bacteria muere. Los gases neurotóxicos utilizados en la 1ª GM inhibían una enzima que participa en la transmisión del impulso nervioso a los músculos (acetilcolinesterasa), produciendo parálisis y muerte. TEMA 11: Enzimas y Vitaminas E + s ES E + P + I EI no habrá reacción](https://image.slidesharecdn.com/t11enzimas-111108113124-phpapp02/85/T11-Enzimas-14-320.jpg)
![COMPETITIVA: El inhibidor es parecido al sustrato y compite por unirse al centro activo que no es capaz de distinguir entre ambos. Si ↑ [S] disminuye la inhibición. Inhibición de la actividad enzimática TEMA 11: Enzimas y Vitaminas REVERSIBLE: el complejo EI puede disociarse recuperando la enzima (E) su funcionalidad. E + I EI Si ↓ [Inhibidor] ↓ grado de inhibición. E + s ES E + P + I EI](https://image.slidesharecdn.com/t11enzimas-111108113124-phpapp02/85/T11-Enzimas-15-320.jpg)


![Tipos de moduladores en la inhibición alostérica Modulador negativo Reactivo Productos Modulador positivo Reactivo Productos V reacción [S] Modulador positivo Modulador negativo Sin modulador No hay reacción Hay reacción A B C D E 1 E 2 E 3 TEMA 11: Enzimas y Vitaminas Centro regulador Centro activo Inhibidor negativo](https://image.slidesharecdn.com/t11enzimas-111108113124-phpapp02/85/T11-Enzimas-18-320.jpg)
![En la reacci ó n enzim á tica hay un l í mite en cuanto a la cantidad de sustrato que el enzima puede transformar por unidad de tiempo : la V max Modelo de Michaelis y Menten (1931) para explicar la cin é tica de las reacciones qu í micas catalizadas por 1 enzima y con 1 solo substrato. La V de la reacción aumenta en función de la [S] hasta un máximo en que se produce la saturación del Enzima: Vmax Km: es la [S] a la que se alcanza la mitad de la Vmax y es una medida de la afinidad Si la Km ↑ : ↓ afinidad del E por S Si la Km ↓ : ↑ afinidad del E por S TEMA 11: Enzimas y Vitaminas Cinética de las reacciones enzimáticas E + S ES E + P A [E] cte V max = velocidad máxima K M = ½ V max = constante de Michaelis](https://image.slidesharecdn.com/t11enzimas-111108113124-phpapp02/85/T11-Enzimas-19-320.jpg)



