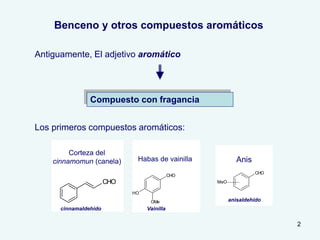
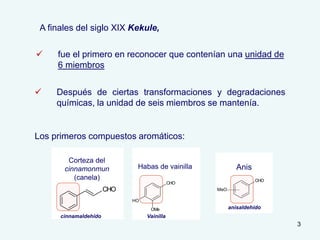
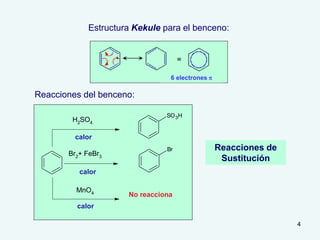
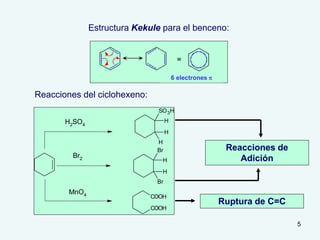
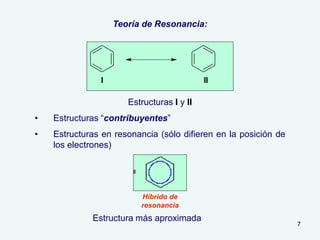
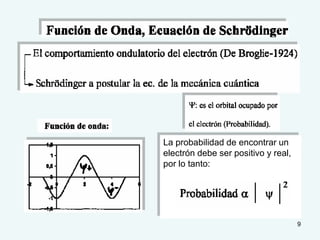
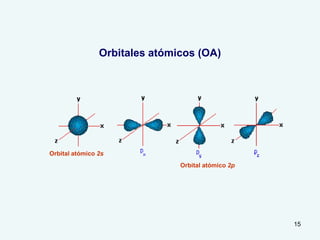
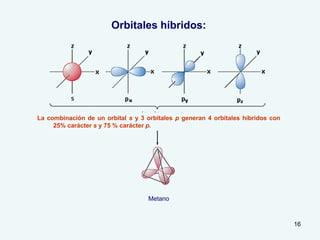
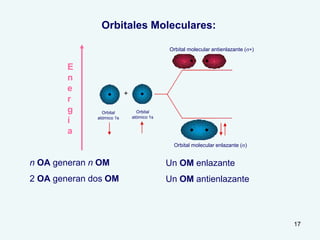
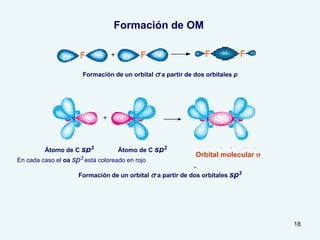
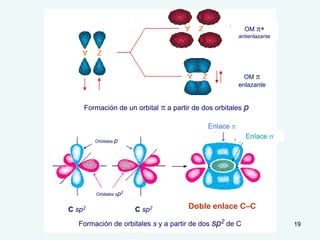
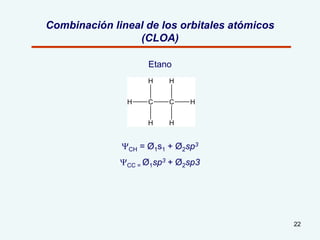
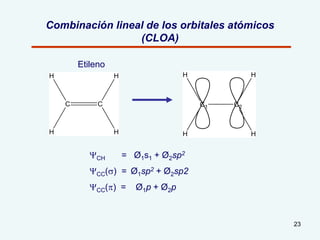
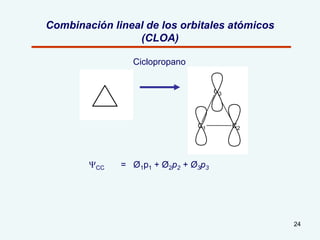
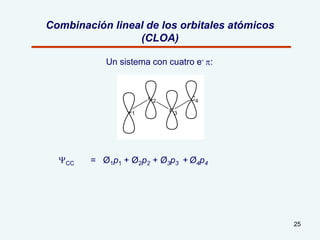
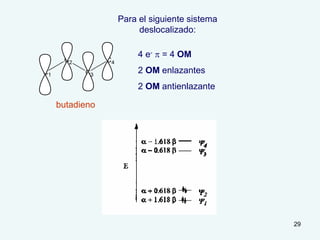
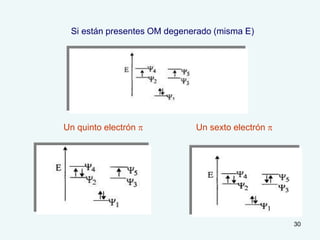
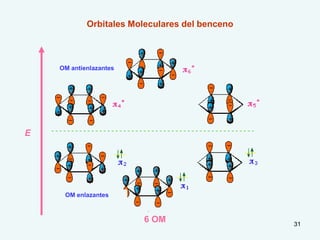
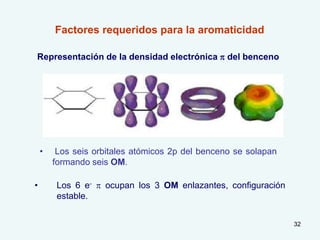
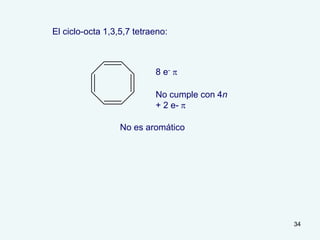
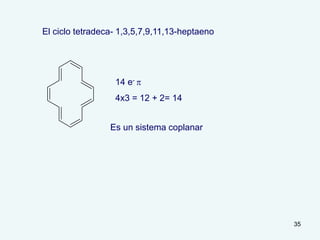
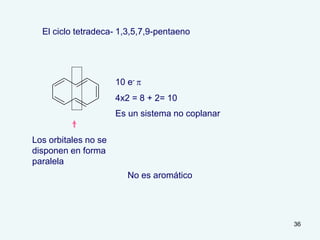
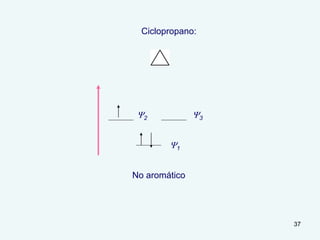
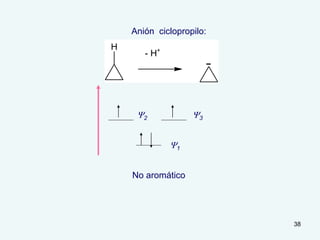
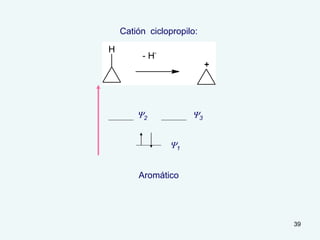
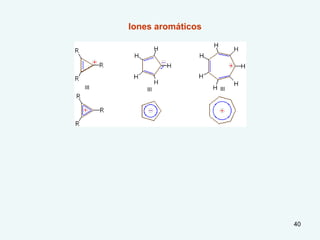
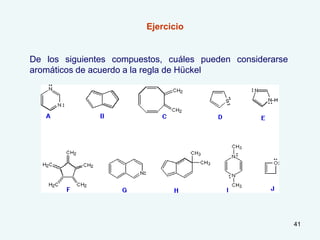
El documento describe el fenómeno de la aromaticidad y las teorías que lo explican. Explica que la teoría de resonancia propone que el benceno tiene una estructura híbrida de resonancia entre dos formas, mientras que la teoría de orbitales moleculares explica que los seis electrones π del benceno ocupan los tres orbitales moleculares enlazantes degenerados. Finalmente, resume los requisitos para que un compuesto sea considerado aromático según la regla de Hückel: debe ser cíclico, tener enlaces dob